תגלית זו תאפשר בעתיד להבין טוב יותר את דרך הפעולה של תרופות כימותרפיות התופסות טרמפ על hCTR1 וחודרות לתא באופן דומה, ולשפר את הטיפול הכימותרפי בסרטן. המחקר פורסם היום בכתב העת המדעי PNAS.

פרופ' ניר בן-טל, הדוקטורנטית מאיה שושן, והמסטרנט יריב ברקן במחלקה לביוכימיה וביולוגיה מולקולארית באוניברסיטת תל אביב בשיתוף עם פרופ' טורקן הלילוגלו מאיסטנבול חישבו את המבנה המפורט ואת דרך הפעולה של חלבון בשם hCTR1 (human copper transporter 1), אחד מהחלבונים הממוקמים בקרום התא (המעטפת השומנית המקיפה כל אחד מתאי גופנו ותוחמת אותו מהסביבה). hCTR1 אחראי על העברת יוני נחושת לתוך התא. בנוסף לתפקיד זה, אותו הועידה לו האבולוציה, הסתבר שהוא מעביר לתוך התא גם את החומר הכימותרפי הפעיל ציספלטין.
לדברי פרופ' בן-טל המחקר הנוכחי הינו שלב ראשון בדרך להבנת דרך חדירתה של התרופה הכימותרפית לתא ועשוי לסייע בעתיד לתכנון תרופות טובות יותר. תוצאות המחקר פורסמו היום בכתב העת המדעי PNAS (רשומות האקדמיה הלאומית האמריקנית למדעים).
כ-30% מהחלבונים בגופנו מרכיבים את קרום התא (ומסייעים לשמירה על איזון חומרים תקין בתוך התא(. לעומת חלבונים הנמצאים בתוך התא, קשה מאוד לקבוע את צורתם התלת ממדית ואת יכולת התנועה של חלבוני קרום התא. עד למחקר הנוכחי היו הפרטים על hCTR1 ידועים ברזולוציה מאוד נמוכה, ולא היה ידוע כלל כיצד הוא נע, ולפיכך באיזה אופן הוא מחדיר את יוני הנחושת לתוך התא.

יוני נחושת, בריכוזים נמוכים, חיוניים לתא ודרושים לפעולתם של אנזימים שונים המשתתפים בתהליכים חיוניים כגון קרישת דם, הגנה בפני אוקסידנטים והנשימה התאית. פגיעה בפעילות האנזימים קושרי הנחושת עשויה על כן לגרום למחלות קשות כגון המופיליה, אנמיה, סכרת ומחלות לב. עם זאת, יון הנחושת כשלעצמו הינו ריאקטיבי ביותר, ונוטה ליצור באופן מהיר רדיקלים חופשיים. כתוצאה מכך התפתחו במהלך האבולוציה מנגנונים מורכבים להעברת היון מ"יד ליד" בשרשרת, כשהידיים השונות הינם חלבונים מסוגים שונים. hCTR1 הינו אחד החלבונים בשרשרת.
"מטרת המחקר שלנו הייתה לחשוף פרטים חדשים לגבי המבנה והתנועה של hCTR1 באמצעות מודלים חישוביים, לאתר חומצות אמינו מסוימות האחראיות לפעילות החלבון ולהציע מנגנון לפעולתו." מסביר פרופ' בן-טל.
במהלך המחקר השוו החוקרים את החלבון בין בעלי חיים שונים וגילו אילו אלמנטים נשמרו לאורך האבולוציה בין המינים השונים ואילו לא נשמרו. בין האלמנטים שנשמרו, איתרו החוקרים את אלו האחראים להעברת יוני הנחושת לתוך התא אצל כל בעלי החיים ולפיכך גם אצל האדם.
"בשלב ראשון השתמשנו במבנה הקיים של החלבון ברזולוציה נמוכה ובמידע האבולוציוני על מנת לנבא את המבנה ברזולוציה גבוהה."

"כל תנועה מסובכת ניתנת לתיאור כסכום של תנועות נדנדה פשוטות המכונות 'אופני תנודה'. בשלב שני, לאחר שניבאנו את מבנה החלבון, חקרנו, בדרך חישובית, את אופני התנודה שלו. גילינו מספר אופני תנודה עיקרים המרכיבים את התנועה הכללית של החלבון. (אופן התנודה העיקרי מוצג בסרט המצ"ב- תמונה 1).
השלב האחרון של המחקר הינו החשוב ביותר: מה ניתן ללמוד מחיזוי המבנה המולקולארי והתנועה של hCTR1 על פעילותו? במקרה זה, החישובים עזרו לנו להציע כיצד מעביר hCTR1 יוני נחושת לתא תוך הגנה בפני הפעילות הרדיקלית המזיקה של היון, כלומר מהו מנגנון הפעולה ברמה המולקולארית (תמונה 2).
"התהליך מתבצע בדרך הבאה: לאחר שיון בודד עובר את הסלקציה, מבנה החלבון משתנה כך שהכניסה לתעלה נחסמת, ויונים נוספים לא יכולים להיכנס. היון שעבר נכנס אל תוך התא, וחוזר חלילה. הכנסת היונים בזה-אחר-זה דרך התעלה מאפשרת בקרה הדוקה על כניסתם לתא. המנגנון מדגים כיצד התא מצליח לקלוט יונים החיוניים לתהליכים שונים תוך בקרה על הפוטנציאל ההרסני שלהם." מסבירה שושן.
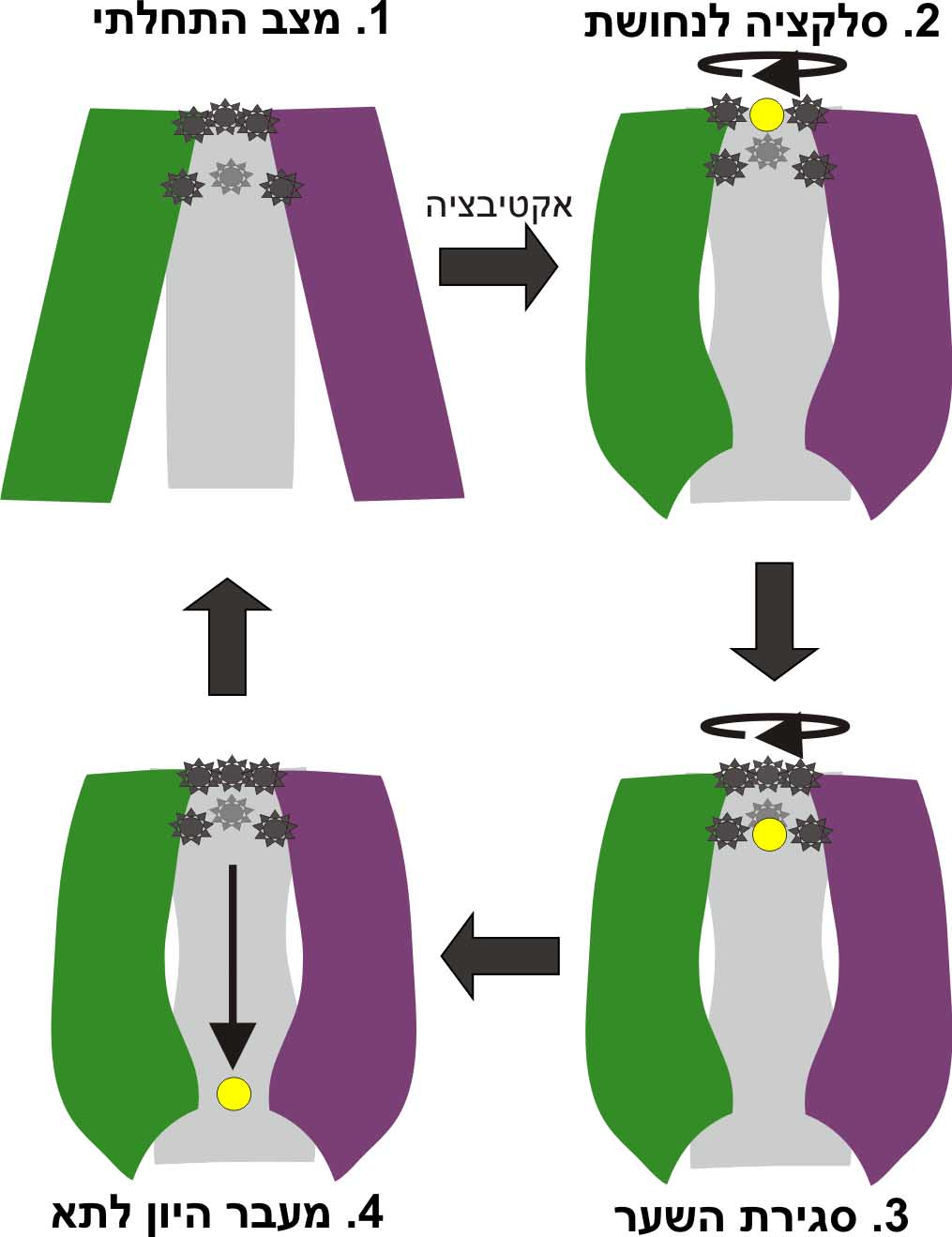
"המחקר מהווה נדבך נוסף בדרך להבנת המנגנון התאי להובלת יון הנחושת". מסביר פרופ' בן-טל "כמו כן, הוא חושף את הייחוד של hCTR1, הן מבחינת הארכיטקטורה הכללית והן מבחינת מנגנון ההולכה, בהשוואה לחלבוני קרום המעבירים יונים אחרים. מכיוון שכאמור hCTR1 מעביר גם ציספלטין, חומר המשמש בטיפולים כימותרפיים יש להבנה זו גם השלכות על חקר מנגנון ההולכה של ציספלטין; הידע הנצבר עשוי להוביל לשיפור בטיפול הכימותרפי.

תגובה אחת
יש לנו חוקרים מצוינים במדינה