הידען > ביולוגיה ורפואה > גנטיקה > התא
התא
- מכון ויצמן
מחקר חדש שנערך בישראל ובאתיופיה, בהובלת חוקרים ממכון ויצמן ומהדסה, חושף כי המיקרוביום מפצה באופן חלקי על הפגיעה שמסב נגיף HIV לתאי המערכת החיסונית ברירית המעי ועשוי להוביל לכיווני טיפול
- מכון ויצמן
מודל מתמטי חדש וניתוח מאגרי תאומים משוודיה, דנמרק וארה״ב מפרידים בין תמותה “חיצונית” להזדקנות – ומכפילים את ההערכות הקודמות
- מכון ויצמן
הסטת מסלול הסופות הנובעת משינויי האקלים משפיעה על התחממות והתייבשות אזורים נרחבים בצפון-מערב אמריקה
- מכון ויצמן
- מכון ויצמן
הממצאים עשויים לשפוך אור חדש על שיבושים בשעון הביולוגי בזמן מחזור, בהריון ובגיל המעבר
- מכון ויצמן
שבב די־אן־אי חדש ממכון ויצמן למדע מייצר על גבי סיליקון עשרות אנטיגנים נגיפיים בניסוי אחד וממפה במהירות את “טביעת האצבע” החיסונית של נבדקים – כלי שעשוי לזרז פיתוח בדיקות, חיסונים,
- מכון ויצמן
חוקרים ממכון ויצמן זיהו מקרופאגים מדכאי חיסון בגידולים ופיתח מולקולות חכמות מסוג MiTEs, המכוונות לקולטן TREM2 ומפעילות מקומית את IL-2 – במטרה להתגבר על עמידות לאימונותרפיה בלי לגרום לתופעות לוואי
- האוניברסיטה העברית
- אין תגובות
צוות האוניברסיטה העברית ו-Believer Meats מראה חידוש תאִי ספונטני בתרביות בקר ללא סימני ממאירות, עם הפעלת טלומראז ו-PGC1α; פוטנציאל לקווי תאים יציבים וייצור בקנה מידה
- הטכניון
- אין תגובות
במאמר בכתב העת היוקרתי Nature Aging מציגים החוקרים מתווה לשיפור יעילותה של מערכת החיסון בגיל המבוגר
- מכון ויצמן
אם נכמת את היקף התנועה האנושית בכדור-הארץ נגלה שאנחנו זזים פי 40 יותר מכל חיות היבשה גם יחד; אם נסתכל על ציר הזמן נראה כי בעוד משקל חיות המשק זינק
- מכון ויצמן
מחקר של מכון ויצמן ואיכילוב מגלה באמצעות אלקטרודות במעמקי המוח כיצד מנגנוני הימנעות מהפסד משפיעים על למידה, זיכרון והפרעות חרדה ופוסט-טראומה
- מכון ויצמן
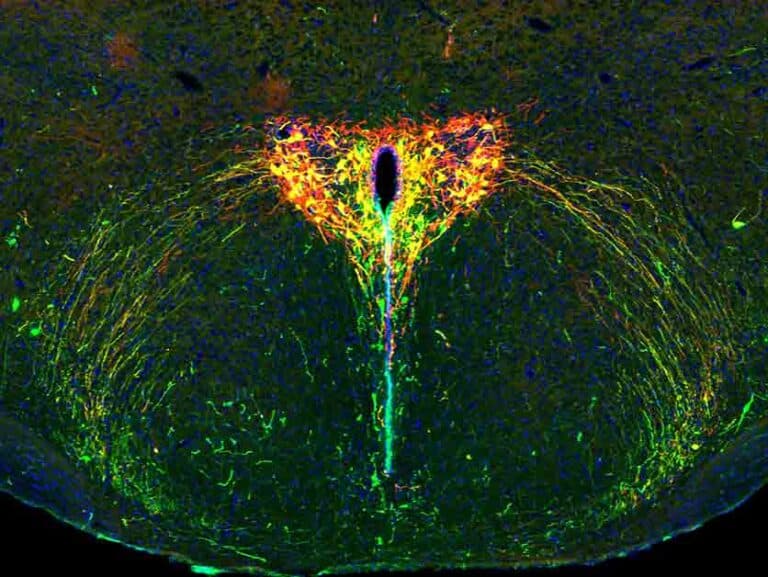
מדעני מכון ויצמן למדע פיתחו טכנולוגיה אופטוגנטית חדשה המאפשרת לחקור את פעילות מערכת האוקסיטוצין בעומק המוח הצעיר. ממצאיהם מראים כי חלבון זה, הידוע כ"הורמון האהבה", משפיע על התמודדות גורי עכברים
- מכון ויצמן
שיתוף פעולה ייחודי בין מכון ויצמן למדע למרכז הרפואי שיבא הוביל לגילויין של שתי תרופות פוטנציאליות למחלה מסכנת חיים של מערכת הלימפה
- מכון ויצמן
מחקר במכון ויצמן למדע מדגים כיצד התקשורת בין המוח לאיברי הגוף משחקת תפקיד קריטי בבריאות ובמחלה
- אתר קול המדע - הקרן הלאומית למדע
חוקרים מהאוניברסיטה העברית זיהו רשת עצבית שפועלת נגד תחושת תגמול – ומציעים גישה טיפולית חדשה להתמודדות עם התמכרות לסמים דרך ויסות הכאב הרגשי בזמן גמילה
- מכון ויצמן
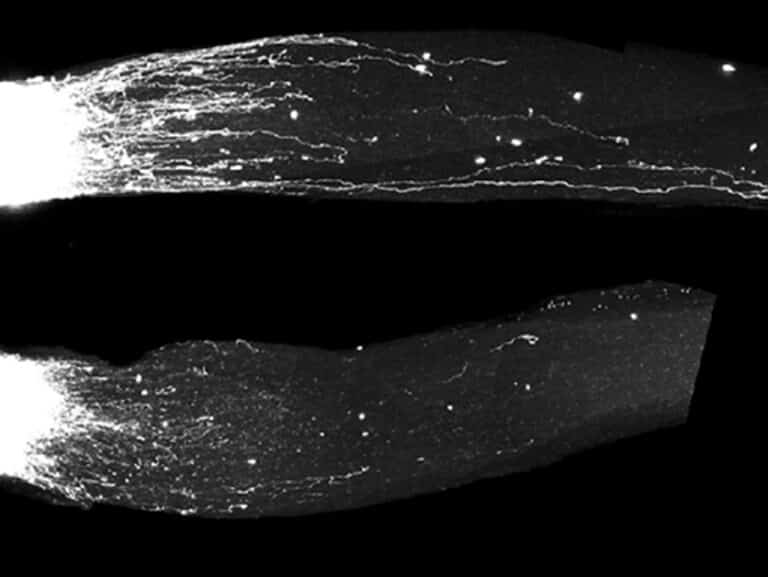
המחקר, שהתפרסם בכתב העת Cell, חושף תפקיד חדש למולקולות אר-אן-אי נדירות, שמסייעות בעצבים היקפיים ואף מעודדות צמיחה מחודשת של תאי עצב במוח. פריצת דרך לטיפול במחלות ניוון ושיקום מפציעות
- מכון ויצמן
חוקרי מכון ויצמן מצאו שתאי עצב חשים שינויים מכניים ברקמות שומן ומווסתים את שריפת האנרגיה בגוף. דיכוי מנגנון זה הופך עכברים לחסינים מהשמנה ומסוכרת
- מכון ויצמן
מדעניות מכון ויצמן למדע חושפות כיצד המערכת החיסונית מאפשרת לנו לאכול כל העולה על רוחנו, מבלי לפתח אלרגיה או מחלה
- מכון ויצמן
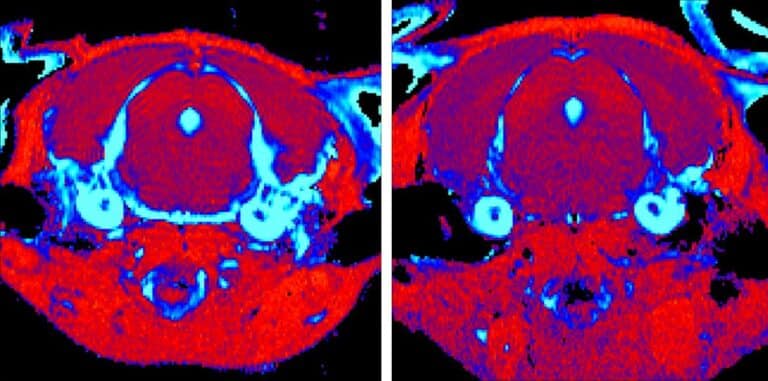
מדעני מכון ויצמן פיתחו שיטה ל-nano-MRI המאפשרת הדמיית מולקולות בודדות בטמפרטורת החדר
- אתר קול המדע - הקרן הלאומית למדע
גרסה משובשת של חלבון המסמן חלבונים פגומים גורמת ליצירת משקעים במוח בדומה למתרחש במחלת אלצהיימר
- מכון ויצמן
מחקר חדש ממכון ויצמן מציג תפנית מרתקת בחקר החושים – שפמי העכברים לא רק חשים מגע, אלא גם מפיקים צלילים שנקלטים במערכת השמיעה ומשמשים לזיהוי עצמים
- מכון ויצמן
מדעני מכון ויצמן למדע חשפו חוקי פיזיקה המסבירים מדוע סדקים בחומר מתפשטים באופן שאינו סימטרי ומניחים בכך את התשתית לפיתוח חומרים עמידים יותר
- מכון ויצמן
- 3 תגובות
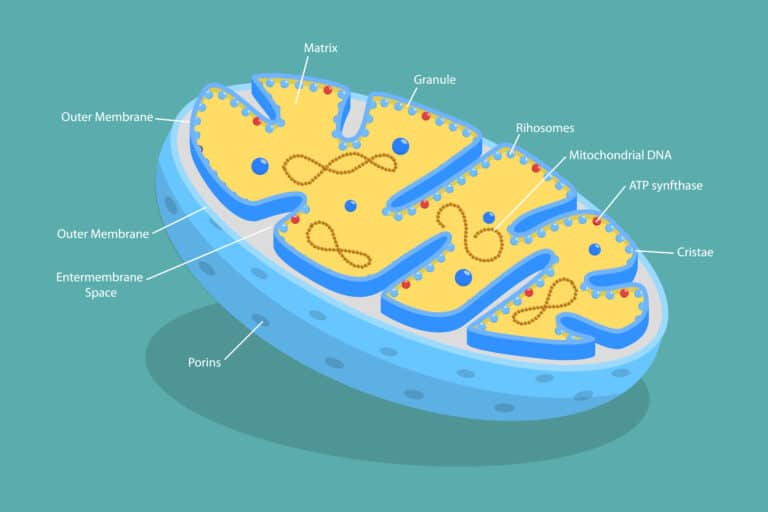
מדעני מכון ויצמן למדע חושפים כיצד החלבון המיטוכונדריאלי מיץ׳ משפיע על השמנה וסיבולת שריר ועשויים לסלול את הדרך לתרופת הרזיה משופרת שלא יהיו בה החסרונות של אוזמפיק
- מכון ויצמן
מדעני מכון ויצמן למדע חשפו כי מנגינת הדיבור באנגלית מתנהגת כשפה עם אוצר מלים ותחביר, וסוללים דרך לבינה מלאכותית שתבין אותה
- מכון ויצמן
מדעני מכון ויצמן למדע חושפים כיצד תאי סרטן שד נכנסים לתרדמה, איך היא נשמרת לאורך שנים – ומדוע הם מתעוררים לפתע ויוצרים גרורות
- מכון ויצמן
במעבדה של פרופ' עידו עמית במכון ויצמן למדע זיהו גן שהשתקתו מתכנתת מחדש תאים של מערכת החיסון ויכולה להפוך אותם מתומכי סרטן למחסליו
- אוניברסיטת בן גוריון
- אין תגובות
- מכון ויצמן
טכנולוגיה מבוססת AI שפותחה במעבדתה של ד"ר ליאת קרן מאפשרת מבט חסר תקדים על תהליכים ברקמות הגוף
- מכון ויצמן
במעבדתה של פרופ' ירדנה סמואלס במכון ויצמן למדע הצליחו לגרום לתאי סרטן להסגיר את עצמם בפני המערכת החיסונית. הגישה החדשה עשויה להעניק תקווה לחולים חשוכי מרפא
- מכון ויצמן
במעבדתה של ד"ר מיטל אורן-סויסה במכון ויצמן גילו כי תולעים זכרים לומדים פחות טוב מהניסיון בהשוואה לנקבות, וחשפו קולטן עצבי שאחראי להבדל בין המינים ושמור גם בבני-אדם
- מכון ויצמן
במעבדתה של פרופ' יפעת מרבל במכון ויצמן למדע נחשף מאגר אדיר של חומרים אנטי-מיקרוביאליים הנוצרים בתאי הגוף באופן טבעי כחלק מתהליך הפירוק של חלבונים שסיימו את תפקידם. התגלית החדשה מהווה
- מכון ויצמן
- מכון ויצמן
אלפי חלבונים תלויים בזנבותיהם כדי להתמקם בקרומי התא ולהוציא לפועל את תפקידיהם החיוניים. שינויים בזנבות עלולים להוביל למחלות גנטיות נדירות
- אבי בליזובסקי
- תגובה אחת
מחקר חדש חושף מנגנון מרתק של "חיפוש מודרך", שבו ה-DNA ומבנה הכרומטין פועלים כ"מפת דרכים", המכוונת חלבונים למטרות גנטיות ספציפיות. המנגנון מספק תובנות חדשות על רכישת זהות תאית עשויות לקדם
- מכון ויצמן
מדעני מכון ויצמן למדע גילו מדוע שעות הלילה הקטנות עשויות להיות מועדות לפורענות
- האוניברסיטה העברית
- תגובה אחת
המחקר מראה כי רצפטורי ה-TAS2R מעורבים בתהליכים רבים כמו נשימה, עיכול ומערכת החיסון. "חוש הטעם ההפוך: מנגנון חישה יוצא דופן התגלה בזיהוי טעם מר בבני אדם"
- האוניברסיטה העברית
- אין תגובות
באמצעות השיטה החדשנית מטה-מודלינג בייסיאני, הצליחו החוקרים לשלב נתונים מטכניקות מיקרוסקופיה מתקדמות וסימולציות סטוכסטיות, ולחשוף דפוסים מורכבים וחדשים באיתות הראשוני של תאי T
- מכון ויצמן
איבר הבליעה של תולעת שקופה חושף את הפוטנציאל הטמון בכלים מתמטיים לחקר מערכות ביולוגיות
- מכון ויצמן
מדעניות המכון חשפו כיצד סרטן שד אלים משבש את התגובה החיסונית נגדו, ופיתחו טיפול באמצעות נוגדן שעשוי להתאים לסוגי סרטן רבים
- מכון ויצמן
הטפיל מחולל המלריה גובה מחיר דמים מהאנושות, לא מעט בזכות יכולתו לייצר גבישים ייחודיים וכהים בתוך תאי הדם שלנו. מחקר חדש מפענח באופן שלם את המבנה של גבישים אלה וסולל
- מכון ויצמן
- מכון ויצמן
טיפול חדשני במחלת גושה מראה תוצאות מבטיחות בעכברים ומעניק תקווה לחולים אחרי עשרות שנות מחקר
- מכון ויצמן
מדעני מכון ויצמן למדע שואבים השראה מהטבע בפיתוח חומרים חדשים למען עתיד ירוק יותר
- דר. משה נחמני
- אין תגובות
שני המדענים הוכרו בזכות תרומתם להבנת מנגנוני הוויסות הגנטי באמצעות גילוי מיקרוRNA – מולקולות RNA זעירות בעלות תפקיד חיוני בתהליכי התפתחות ותפקוד בתאים
- מכון ויצמן