שני המדענים הוכרו בזכות תרומתם להבנת מנגנוני הוויסות הגנטי באמצעות גילוי מיקרוRNA – מולקולות RNA זעירות בעלות תפקיד חיוני בתהליכי התפתחות ותפקוד בתאים
הוכרזו הזוכים בפרס נובל ברפואה: פרופ' ויקטור אמברוז ופרופ' גארי רובקון היהודי על גילוי מיקרו RNA – מולקולות RNA קטנות. לפני עשור זכו בפרס וולף הישראלי עם החוקר הישראלי-קנדי פרופ' נחום זוננברג – שלא זכה איתם בנובל. אמברוז ורובקון שהו יחד בהשתלמות פוסט-דוקטורט במכון הטכנולוגי של מסצ'וסטס (MIT) ,מעבדה של רוברט הורביץ, חתן פרס נובל היהודי-אמריקני לשנת 2002.
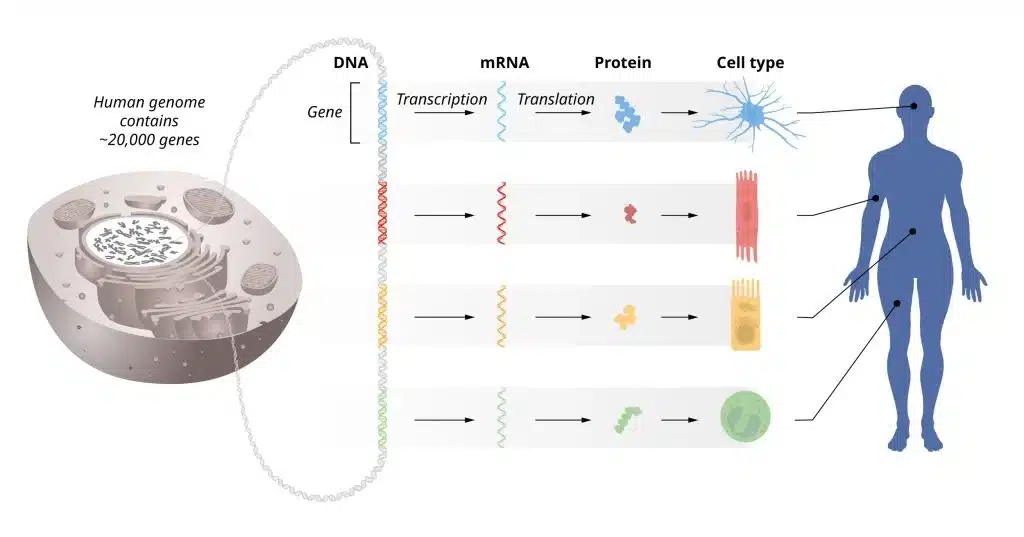
פרס הנובל לשנת 2024 הוענק לשני מדענים עבור התגלית שלהם על עיקרון יסוד השולט בפעילות הגנים. המידע המאוחסן בתוככי הכרומוזומים שלנו יכול להיות מקושר לסוג של מדריך הפעלה עבור כל התאים בתוככי הגוף שלנו. כל תא בגוף מכיל בתוכו כרומוזומים זהים, כך שכל תא מכיל בתוכו את אותו אוסף זהה של גנים ואת אותם הוראות הפעלה. ועדיין, סוגי תאים שונים, למשל תאי שריר או תאי עצב, כוללים מאפיינים נבדלים מאוד. כיצד הבדלים אלו צצים? התשובה היא וויסות גנים, המאפשר לכל תא לבחור רק את ההוראות הרלוונטיים לו. מנגנון זה מוודא כי רק האוסף הנכון של הגנים מופעל בכל סוג וסוג של תא.
פרופ' גארי רובקון ו פרופ' ויקטור אמברוז תהו כיצד מתפתחים סוגי תאים שונים. הם גילו את המולקולה הקרויה בשם מיקרו-רנ"א, סוג חדש של מולקולות רנ"א זעירות האחראיות לתפקיד חיוני בוויסות גנים. התגלית פורצת הדרך והמהפכנית שלהם חשפה עיקרון חדש לחלוטין בתחום של וויסות גנים החיוני לאורגניזמים רב-תאיים, לרבות בני אדם. כיום ידוע כי הרצפים של הגנום האנושי מקודדים יותר ממאה אלף מיקרו-רנ"א. התגלית המפתיעה שלהם חשפה מימד חדש לחלוטין עבור וויסות כנים. מיקרו-רנ"א הוכחו כמשמעותיים באופן יסודי לאופן שבו אורגניזמים מתפתחים ומתפקדים.
הוויסות החיוני של גנים בבסיס פרס הנובל של שנה זו ברפואה מתמקד בתגלית של מנגנון וויסות חיוני בתאים המשמש לבקרה על פעילות הגנים. מידע גנטי זורם מדנ"א לרנ"א שליח (mRNA) באמצעות תהליך הקרוי בשם "שיעתוק" (transcription) ובשלב הבא דרך מנגנון תאי לייצור חלבונים. בשלב זה, מיקרו-רנ"א משוכפלים ומאפשרים בכך הפקה של חלבונים על סמך ההוראות הגנטיות המאוחסנות בדנ"א עצמו. מאז אמצע המאה העשרים אחדות מהתגליות המדעיות הבסיסיות הסבירו כיצד תהליכים אלו פועלים. האיברים והרקמות שלנו מורכבים מסוגי תאים שונים רבים, כולם כוללים מידע גנטי זהה המאוחסן בתוך הדנ"א שלהם. יחד עם זאת, תאים שונים אלו מבטאים אוספים ייחודיים של חלבונים. כיצד זה מתאפשר? התשובה נמצאת בוויסות המדויק של פעילות הגנים, כך שרק האוסף "הנכון" של הגנים פעיל בכל אחד מסוגי התאים. מנגנון זה מאפשר למשל, יצירה של תאי שריר, תאי מעיים, וסוגים שונים של תאי עצב, המבצעים את הפונקציות הייחודיות שלהם.
בנוסף, הפעילות הגנטית חייבת להיות מבוקרת תמיד על מנת להתאים לפונקציות תאיות כך שיסתגלו לתנאים משתנים בגוף ובסביבה שלנו. אם הוויסות הגנטי משתבש, הליקוי הזה יכול להוביל למחלות חמורות כגון סרטן, סוכרת, או מחלות של נוֹגְדָנוּת עצמית (autoimmunity). לפיכך, הבנת מנגנון הוויסות של פעילות הגנים מהווה מטרה חיונית מזה עשורים רבים.
בשנות התשעים היה ידוע כי חלבונים ייחודיים, הידועים בשם "פקטורי שיעתוק" (transcription factors) נקשרים לאזורים ספציפיים בדנ"א ושולטים על הזרימה של המידע הגנטי על ידי קביעת המיקרו-רנ"א שמיוצרים. מאז זוהו אלפי פקטורי שיעתוק וזמן רב לאחר מכן החוקרים סברו כי העקרונות העיקריים של וויסות גנים נחשפו במלואם.
אולם, בשנת 1993 חתני פרס הנובל לשנה זו פרסמו מממצאים בלתי צפויים המתארים רמה חדשה של וויסות גנים, אשר הוכחו להיות משמעותיים ביותר ואפילו נשמרים לאורך האבולוציה.
מחקר על תולעים זעירות הוביל לפריצת דרך עצומה
בשנות השמונים של המאה הקודמת שני החוקרים היו עמיתי בתר-דוקטורטים במעבדתו של רוברט הורוביץ (Robert Horvitz), אשר קיבל את פרס נובל לשנת 2002, ביחד עם סידני ברנר (Sydney Brenner) וכן ג'ון סלסטון (John Sulston). במעבדתו של הורוביץ הם חקרו תולעים עגולות זעירות, כֶּרֶץ (roundworm) באורך של מ"מ אחד בלבד. למרות הגודל הזעיר שלו, התולעת C. elegans היא בעלת סוגי תאים רבים כגון תאי עצב ותאי שריר, תאים שנמצאו גם בחיות גדולות ומורכבות יותר, מה שהפך אותן למודל שימושי לבדיקת המנגנון של התפתחות וגדילה של אורגניזמים רב-תאיים. שני החוקרים התעניינו בגנים אשר שולטים את התזמון של ההפעלה של "תוכנות" גנטיות שונות, מנגנון המוודא כי סוגי תאים שונים מתפתחים בזמן הנכון. הם חקרו שני זנים מוטנטיים של תולעים [lin-4 lin-14] אשר ביטאו פגמים בתזמון ההפעלה של תוכנות גנטיות במהלך ההתפתחות התאית. שני חתני פרס הנובל רצו לזהות את הגנים המוטנטיים ולהבין את הפונקציות שלהם. אמברוז הראה בעבר כי הגןlin-4 הוא ווסת שלילי של הגן lin-4.
יחד עם זאת, כיצד הפעילות של גן זה נחסמה הייתה בלתי ידועה עד אז. שני החוקרים התענינו במוטנטים אלו ובפוטנציאל שלהם לפתור את התעלומות הללו.
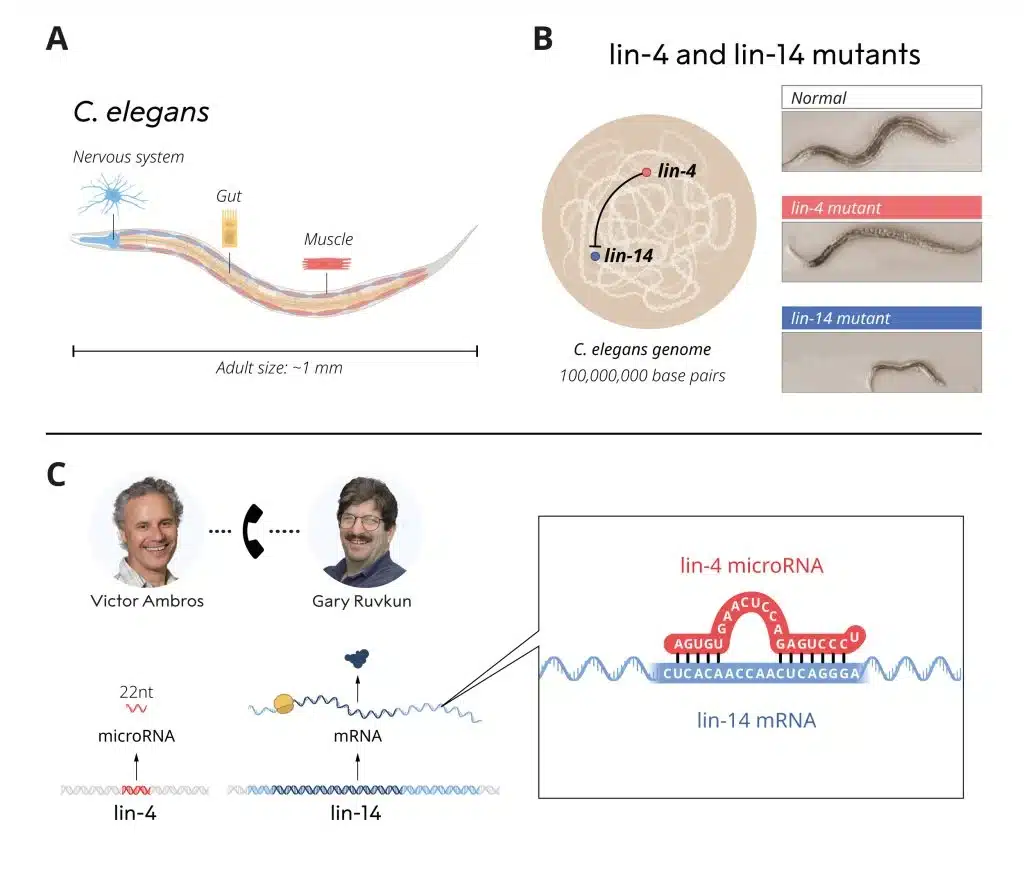
סקירה של *C. elegans* ומחקר גנטי על מוטציות lin-4 ו-lin-14. באדיבות וועדת פרס נובל לרפואה, 2024
לאחר שלב הבתר-דוקטורט שלו, החוקר ויקטור אמברוז ניתח את המוטנט לין-4 במעבדתו החדשה באוניברסיטת הרווארד. מיפוי שיטתי ושיבוט של הגן הובילו לגילוי של ממצא בלתי צפוי – מולקולת רנ"א קצרה שאין בה צופן לייצור חלבון. תוצאות מפתיעות אלו, מרמזות כי רנ"א קטן זה שהופק מוך לין-4 היה אחראי לעיכוב של לין-4. כיצד הדבר יכול לקרות?
בו זמנית, פרופ' גארי רובקון חקר את הוויסות של הגן לין-4 במעבדתו החדשה בביה"ח הכללי של מסצ'וסטס ובביה"ח לרפואה של אוניברסיטת הרווארד. שלא כמו שהיה מקובל לשער בזמנו על התפקוד של גנים במסגרת וויסות גנטי, רובקון הראה שאין זה התוצר של מיקרו-רנ"א שהופק מתוך לין-14 שמעוכב על ידי לין-4. נראה כי הוויסות מתרחש בשלב מאוחר יותר בתהליך ביטוי הגנים, דרך כיבוי יצור החלבון. ניסויים נוספים חשפו מקטע בתוך המיקרו-רנ"א של לין-14 שהיה הכרחי לעיכוב שלו על ידי לין-4. שני החוקרים השוו בין הממצאים שלהם, עובדה שהביאה לתגלית פורצת דרך. הרצף הקצר של לין-4 תאם לרצפים מתאימים (complementary) בתוך המקטע ההכרחי של מיקרו-הרנ"א של לין-14. שני החוקרים ביצעו ניסויים נוספים שהראו כי מיקרו-הרנ"א של לין-14 נכבה בעקבות קישור לרצפים המתאימים במיקרו-רנ"א. תוך חסימת הייצור של החלבון לין-14. עיקרון חדש בתחום של וויסות גנטי, המתווך על ידי רנ"א שלא היה ידוע עד אז, מיקרו-רנ"א, התגלה ברגע זה. הממצאים פורסמו בשנת 1993 בשני מאמרים בכתב העת המדעי Cell.
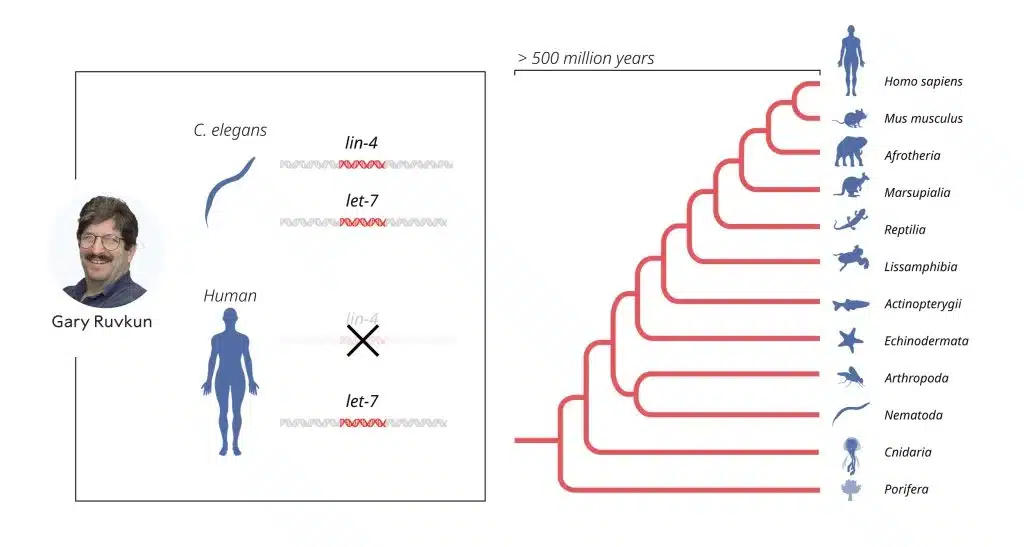
הממצאים שפורסמו התקבלו בתחילה בדממה בקרב הקהיליה המדעית. על אף שהממצאים היו מעניינים, המנגנון הבלתי רגיל של וויסות גנטי נחשב לתכונה ייחודית רק של התולעת הספציפית שנבדקה C. elegans, כלומר שהממצאים כנראה אינם רלוונטיים לבני אדם ולבעלי חיים מורכבים אחרים. התפיסה המדעית בתחום השתנתה בשנת 2000 כאשר קבוצת המחקר של רובקון פרסמה את התגלית שלה אודות מיקרו-רנ"א נוסף המקודד על ידי הגן let-7. שלא כמו הגן הקודם, לין-4, הגן לט-7 היו משומר במיוחד במהלך ההתפתחות האבולוציונית ונמצא קיים בכלל ממלכת בעלי החיים. מאמר זה דווקא זכה לעניין רב, ובמהלך השנים שלאחריו התגלו מאות מולקולות מיקרו-רנ"א שונות. כיום, אנו יודעים כי קיימים יותר מאלף גנים המקודדים מיקרו-רנ"א שונים בבני האדם, וכי וויסות גנטי על ידי מיקרו-רנ"א הוא מנגנון אוניברסלי בקרב אורגניזמים רב-תאיים.
בנוסף למיפוי של מיקרו-רנ"א חדשים, ניסויים שנערכו על ידי קבוצות מחקר אחדות הראו כיצד המנגנונים של מיקרו-רנ"א מיוצרים ומועברים רצפי מטרה תואמים בצורה מווסתת. הגילוי של מיקרו-רנ"א מוביל לעיכוב של סינתזת חלבונים או לפירוק של מיקרו-רנ"א. באופן מעניין, מיקרו-רנ"א יחיד יכול לווסת את הביטוי של גנים שונים ורבים, ובאופן מקביל, גן יחיד יכול להיות מווסת על ידי מספר מיקרו-רנ"א כך שהמנגנון מתואם ומכוונן במטרה לתכלל רשתות של גנים. המנגנון התאי של ייצור מיקרו-רנ"א תפקודיים מנוצל גם על מנת לייצור מולקולות רנ"א קטנות אחרות הן בצמחים והן בבעלי חיים, לדוגמא כאמצעי להגנת צמחים מפני זיהומים ויראליים. החוקרים Andrew Z. Fire וכן Craig C. Mello, שזכו בפרס נובל בשנת 2006, תיארו ממשק של רנ"א, שבו מולקולות מיקרו-רנ"א ספציפיות מושבות על ידי הוספת רנ"א דו-גדילי לתאים.
עוד בנושא באתר הידען:
