מדעני מכון ויצמן למדע פענחו תעלומה בת 50 שנה וזיהו מנגנון מולקולרי שאחראי להתחדשות רקמה לאחר הרס נרחב; בכך הם סוללים דרך לטיפולים שיאיצו החלמה מפציעות ואף יסייעו למנוע צמיחה מחדש של סרטן
כמו עוף החול שקם לתחייה מן האפר, גם רקמת העור שלנו ובכלל רקמות שמצפות את הגוף מבפנים ומבחוץ ומכונות אפיתל, יכולות להגיב בפרץ התחדשות לאחר מוות והרס. תופעה זו המכונה "גדילה מפצה" (compensatory proliferation) התגלתה כבר בשנות ה-70 בזחלי זבובים שהצמיחו כנף תקינה לאחר שרקמת האפיתל שלהם נהרסה בעקבות חשיפה לקרינה חזקה. מאז תועדה התופעה המפתיעה במגוון בעלי-חיים, כולל בני-אדם, אך לא היה ברור כיצד היא אפשרית. מחקר חדש ממכון ויצמן למדע, המתפרסם בכתב-העת המדעי Nature Communications, חושף כי דווקא מכונות ההרס והמוות של התא – אנזימים המכונים קספאזות – הן שעשויות להעניק לחלק מהתאים חסינות ממוות, וכך לאפשר לרקמה שנפגעה להשתקם ואף להפוך לעמידה יותר. למרבה הצער, מנגנון זה מאפיין גם סוגי סרטן רבים, וייתכן שבו טמון ההסבר לחזרתם של גידולים שחוסלו, בגרסה אלימה ועמידה יותר. הממצאים החדשים עשויים לסלול את הדרך לטיפולים שיאיצו שיקום מפציעות ואף יסייעו למנוע הישנות סרטן.
צורת המוות הנפוצה ביותר של תאים בגוף הבריא היא אפופטוזה – "התאבדות" מתוכננת ומסודרת של התא שמתרחשת כאשר הוא מזדקן, ניזוק או מקבל מהסביבה מסר שעליו לסיים את חייו. בתהליך זה, קספאזה ראשונית מתחילה את מסלול המוות ומפעילה קספאזות מוציאות לפועל, הקורעות לגזרים את חלבוני התא. מחקרים מעשרים השנים האחרונות, שבוצעו במעבדות ברחבי העולם וגם במעבדתו של פרופ' אלי ארמה במחלקה לגנטיקה מולקולרית במכון, חשפו עדויות לכך שהקספאזות משחקות תפקיד מרכזי לא רק במוות תאי – אלא גם בתהליכי החיים. תגליות אלו הולידו בקרב פרופ' ארמה, מהחלוצים בתחום, את ההשערה שקספאזות עשויות לעמוד גם מאחורי התופעה המסתורית של גדילה מפצה.
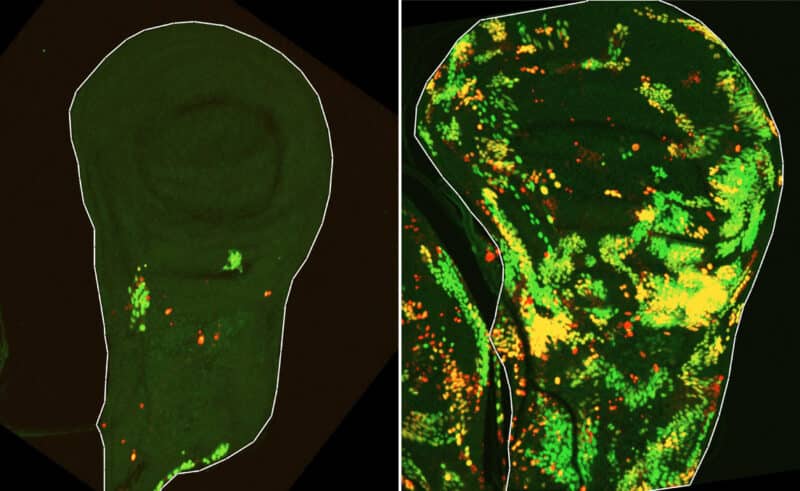
במחקר החדש, שהובילה ד"ר צליל בראון ממעבדתו של פרופ' ארמה, חזרו המדענים לניסוי המקורי שבו התגלתה התופעה המסתורית, והקרינו זחלים של זבובי דרוזופילה בקרינה מייננת – כשהפעם בעזרת טכנולוגיות חדשניות יכלו לעקוב בדקדקנות אחר התחדשות רקמת האפיתל. "ניסינו לזהות ברקמה תאים שלוחצים על כפתור ההשמדה העצמית אבל נשארים בחיים", מתארת ד"ר בראון. "לשם כך, השתמשנו ב'חיישן מושהה', שידע לדווח לנו על תאים ששרדו את ההקרנה, אף שהופעלה בהם הקספאזה הראשונית. כך חשפנו אוכלוסיית תאים שקראנו להם תאי DARE – תאים אלה לא רק ששרדו את ההקרנה, הם התרבו, שיקמו את הרקמה הפגועה ומילאו כמעט מחצית ממנה בחלוף שתי יממות". אבל מי היו שאר התאים ברקמה המתחדשת?
"זיהינו אוכלוסייה נוספת של תאים שאף הם היו עמידים למוות, אך בשונה מתאי DARE לא הופעלה בהם כלל הקספאזה הראשונית, לתאים אלה קראנו תאי NARE", מוסיפה ד"ר בראון. "אף שתאים אלו תרמו בסופו של דבר להתחדשות הרקמה, לא היה ביכולתם לעשות זאת בעצמם: כשהעלמנו את תאי DARE מהתמונה, נעלמה גם הגדילה המפצה. בנוסף, גילינו שגם לתאים המתים ברקמה יש תפקיד בפרץ ההתחדשות – אותות תקשורת בין התאים המתים לתאים השורדים עודדו את התרבותם של האחרונים".
בשלב הבא, פענחו המדענים את מנגנון ההישרדות של תאי DARE. "הבחנו שאף שמופעלת בהם הקספאזה הראשונית, תהליך המוות התאי נעצר שם ואינו מתקדם לשלב הבא", מסביר פרופ' ארמה. "חשדנו שאחראי לכך חלבון הידוע כ'עוגן מולקולרי' ואשר ביכולתו לקשור את הקספאזה הראשונית בסמוך לקרום התא, וכך למנוע ממנה להפעיל את הקספאזות המוציאות לפועל. ואכן, כאשר ביטלנו את ביטויו, תהליך המוות של תאי ה-DARE נמשך ושיקום הרקמה נפגע. הפעלת יתר של אותו חלבון עוגן נקשרה בעבר לצמיחת גידולים סרטניים, וייתכן שמנגנון זה הוא אחד המנגנונים שמאפשרים לתאי סרטן לחמוק ממוות".
ידוע גם כי גידולים סרטניים הצומחים מחדש לאחר טיפולים בהקרנות נוטים להיות עמידים לטיפול ואלימים יותר. "ניסינו להבין האם התכונה של עמידות למוות עוברת בירושה מתאים עמידים למוות ששרדו הקרנה אחת לשאר צאצאיהם", אומר פרופ' ארמה. "הבחנו כי כאשר מקרינים את אותה רקמה פעם נוספת, מספר התאים שמתים בשעות הראשונות לאחר ההקרנה השנייה נמוך בחצי ביחס להקרנה הראשונה ומרבית המתים משתייכים לאוכלוסיית תאי NARE. במלים אחרות, צאצאיהם של תאי DARE התגלו כעמידים במיוחד – פי שבעה יותר חסינים למוות מהתאים ברקמה המקורית. מנגנון זה עשוי להסביר כיצד גידולי סרטן חוזרים הופכים לעמידים יותר לאחר טיפול בהקרנות".
איזון עדין בין שיקום הרקמה לבין גדילת יתר הוא מרכיב חיוני בכל תהליך התחדשות, ובחלק האחרון של המחקר חשפו המדענים כיצד נמנעת יציאה משליטה בעת תיקון רקמה לאחר פגיעה. "תאי DARE מעודדים גדילה של תאי NARE סמוכים, ככל הנראה באמצעות הפרשת גורמים מעודדי גדילה, ואילו תאי NARE בתורם מפרישים אותות שדווקא מעכבים גדילה של אותם תאי DARE", מתאר פרופ' ארמה. "למעשה, נחשף כאן מנגנון משוב שלילי בין אוכלוסיות התאים שמונע גדילת יתר".
"אנחנו מקווים שכפי שנעשה פעמים רבות עם מודלים מחקריים בזבובים, ניתן יהיה לתרגם את הידע שנצבר להבנת המנגנונים המאזנים גדילה ומקנים עמידות למוות תאי ברקמות אנושיות", אומר פרופ' ארמה. "גידולים סרטניים רבים מקורם בתאי אפיתל שיצאו משליטה, וחלק ניכר מהטיפולים המסורתיים בסרטן הינם אסטרטגיות שונות לגרום להם להשמיד את עצמם באמצעות אפופטוזה. הממצאים סוללים את הדרך להבין מדוע הטיפולים נכשלים לעיתים ואיך ניתן לשפרם. בהיבט אחר, התוצאות מרמזות לנו כיצד ניתן יהיה אולי להאיץ התחדשות רצויה של רקמות בריאות לאחר פציעה".
במחקר השתתפו גם נעמה עפגין, ד"ר לנה ספוז'ניקוב וד"ר קרן יעקובי-שרון מהמחלקה לגנטיקה מולקולרית במכון; ד"ר אהוד סיון מהמחלקה לתשתיות מחקר מדעי החיים במכון; פרופ' אנדראס ברגמן מאוניברסיטת מסצ'וסטס; ופרופ' לואיס אלברטו באנה-לופז מהמרכז לביולוגיה מולקולרית ע"ש סברו אוצ'ואה (CBMSO), ספרד.

