חוקרים מהאוניברסיטה העברית זיהו רשת עצבית שפועלת נגד תחושת תגמול – ומציעים גישה טיפולית חדשה להתמודדות עם התמכרות לסמים דרך ויסות הכאב הרגשי בזמן גמילה
פרופ’ רחל נחושתאי מהאוניברסיטה העברית חוקרת את MiNT (CISD3) – חלבון שלא נחקר עד כה לעומק – ומגלה את תפקידו הקריטי בשמירה על תקינות המיטוכונדריה, בבריאות שרירי השלד והלב, ובהגנה מפני נזק חמצוני.
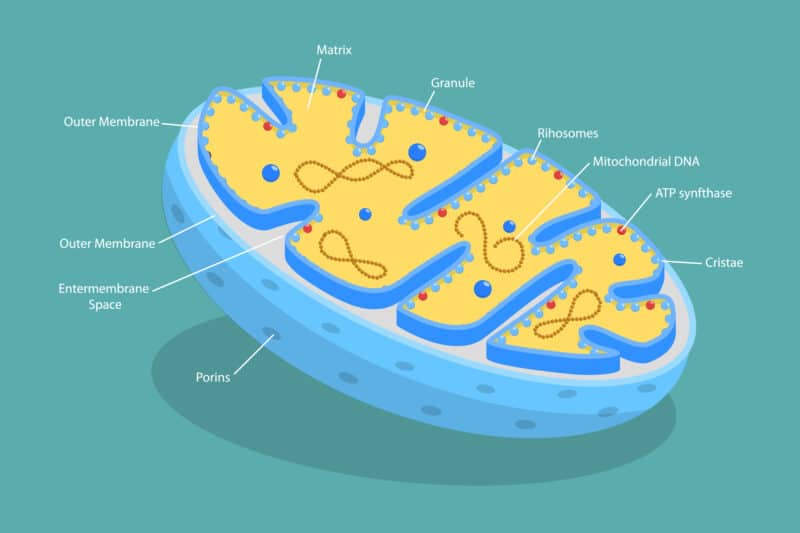
בתאי גופנו פועלות אלפי מערכות מתואמות שמייצרות אנרגיה, בונות רקמות ושומרות על איזון מטבולי עדין. אחת החשובות שבהן היא מערכת חלבונים המכילה מקבצי ברזל-גופרית ([2Fe-2S]) , הממוקמת במיטוכונדריה – תחנת הכוח של התא. את המערכת הזו חוקרת בעשור האחרון פרופ’ רחל נחושתאי מהאוניברסיטה העברית, כשהיא מתמקדת בחלבון מסתורי במיוחד: MiNT, או בשמו הגנטי CISD3.
החלבון הזה, השייך למשפחת חלבוני NEET, היה עד לאחרונה כמעט בלתי מוכר. בעוד שחבריו למשפחה – CISD1 ו־ CISD2 – כבר נקשרו למחלות כמו סוכרת, מחלות נוירולוגיות תורשתיות ואף סרטן, ל־ CISD3 טרם יוחס כל תפקיד ברור. “במשך שנים אף אחד לא ידע מה הוא עושה,” מספרת נחושתאי. “אבל דווקא משום כך – הרגשנו שאנחנו חייבים להבין.”
המעבדה שלה יצרה מודל עכברים מהונדסים גנטית החסרים את החלבון MiNT. ובתוך זמן קצר, התברר שמדובר בחלבון חיוני: העכברים החלו לאבד יכולת תנועה, סבלו מהתנוונות שרירים, והראו תסמינים המזכירים מחלה מוכרת מאוד – ניוון שרירים על שם דושן. (DMD) “לא היה מדובר בפגם אחד מבודד – אלא בקריסה כוללת של תפקוד המיטוכונדריה בשרירי השלד והלב,” היא מסבירה.
בדיקות מיקרוסקופיות חשפו פגיעה קשה במבנה המיטוכונדריות, כולל העלמות הממברנה הפנימית. מדידות תפקודיות גילו ירידה חדה ביכולת ייצור האנרגיה (ATP) דרך מסלול הנשימה התאית (OXPHOS), בעוד שמסלול הגליקוליזה – המתרחש מחוץ למיטוכונדריה – נשמר. “זה היה רמז ברור לכך שהבעיה ממוקדת במיטוכונדריה, עצמה” אומרת פרופ’ נחושתאי.
אבל החידוש האמיתי במחקר אינו רק באפיון הפגם, אלא בהבנת תפקידו הייחודי של MiNT כ”צ’פרון” – מולקולה “מלווה” שמעבירה את מקבצי הברזל-גופרית בתוך התא. מקבצים אלה דרושים לתפקוד של אנזימים רבים, ובעיקר לאיזון ברזל, קלציום ורדיקלים חופשיים. “אנחנו חושבים ש־MiNT הוא השחקן המרכזי שמעביר את הצבר ברזל-גופרית מהמטריקס המיטוכונדריאלי לציטוזול, ושומר על תקינות כללית של התא,” היא מדגישה.
פרופיל פרוטאומי רחב שבוצע על שרירי העכברים הראה ירידה של כ־30% בביטוי חלבונים מיטוכונדריאליים. החוקרים השוו את הדפוסים הללו לפגיעות מוכרות ממחלות כאחרות בהם יש פגיעה בשרירים כמו פרקינסון, אלצהיימר, טרשת נפוצה והנטינגטון, ומצאו חפיפות מובהקות. “מצאנו נזק דומה לזה שרואים גם בהזדקנות ובמחלות ניווניות,” מציינת נחושתאי. “במילים אחרות, החלבון הזה לא רק חשוב – הוא כנראה מגן מפני קריסה של מערכות שלמות בגוף.”
פרויקט המחקר נתמך על ידי הקרן הלאומית למדע, ומבוסס על שיתוף פעולה עם פרופ’ רון מיטלר מאוניברסיטת מיזורי, שאיתו פותח מודל העכברים על ידי הפוסט דוקטורנטית במשותפת ד”ר עלא כרמי. החוקרת מתכננת להרחיב את הניסויים גם לתאים קרדיאליים ולרקמות כלי דם, מתוך הנחה שהחלבון MiNT חיוני לא רק לשריר – אלא גם לשמירה על שלמות כלי הדם, מניעת טרשת עורקים ופגיעות נוספות הקשורות ברדיקלים חופשיים.
מעבר לכך, קבוצת המחקר שלה בודקת דרכים להשיב את תפקוד החלבון באמצעות מוטנטים מתוקנים או מולקולות קטנות שיכולות לחקות את פעילותו. “אם נצליח לפתח דרך לעורר את החלבון או להחליפו בתאים פגועים – זה עשוי להיות הבסיס לטיפול במחלות ניווניות של השריר, הלב ואולי אפילו המוח והלב” היא אומרת בזהירות.
פרופ’ נחושתאי נחשבת כיום לאחת החוקרות המרכזיות בעולם של חלבוני ה-NEET. “עבורי,” היא מסכמת, “המחקר הזה הוא לא רק על חלבון – הוא על הבנה עמוקה של מה שגורם לגוף לתפקד, ומה משתבש כשזה נפגע ו/או נעלם. והבנה כזו היא הבסיס לכל פריצת דרך רפואית בעתיד.”
למרות שהיא מזוהה כיום עם מחקר בביולוגיה מולקולרית וביוכימיה של התא, דרכה המדעית של פרופ’ רחל נחושתאי החלה דווקא בתחום הביו-פיזיקה. את מחקריה הראשונים ערכה בתחום הפוטוסינתזה בצמחים, מתוך עניין עמוק באנרגיה ובמנגנוני קליטת אור. עם השנים, ואחרי שהשתתפה במחקרים בולטים באוניברסיטאות בארה״ב, היא החליטה לעבור לחקר תאים בבעלי חיים – צעד שלדבריה היה טבעי: “בשלב מסוים הרגשתי שהאתגר האמיתי הוא להבין איך זה עובד בגוף שלנו – לא רק בצמחים. קיים הרבה ידע על תיפקוד חלבוני ברזל-גופרית בצמחים, אבל בבעלי חיים במיטוכונדריה תחושתי היתה שנוכל לפענח תהליכים חדשים. ככלל הביולוגיה האנושית היא כמו רשת עצומה של תהליכים שעדיין לא פענחנו.”
עוד בנושא באתר הידען:
