חוקרים מיפן גילו דרך לעצור את התפתחות סיבי העמילואיד β, הקשורים למחלת האלצהיימר, באמצעות נוגדן המאפשר לעצור או לעכב את התפתחות הסיבים. פריצת דרך זו עשויה לסייע בפיתוח טיפולים חדשים למחלת האלצהיימר
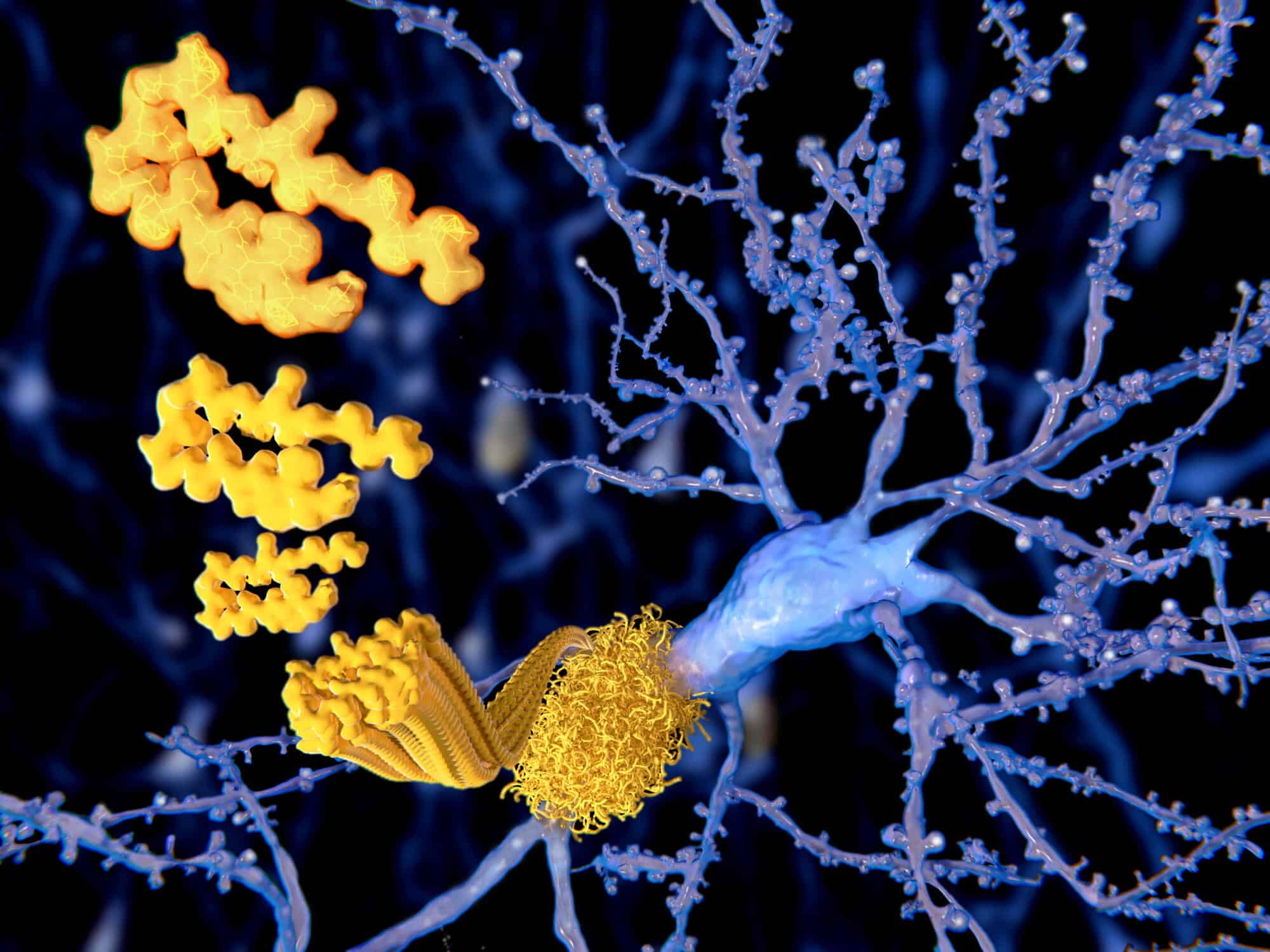
חוקרים זיהו מנגנון מפתח בהתפתחות מחלת האלצהיימר, הכולל את הצמיחה והעיכוב של סיבי עמילואיד β (Aβ). נוגדן שנמצא לאחרונה מסוגל לעצור את התפתחות הסיבים, ובכך להציע גישה חדשה לטיפול שמכוונת לנקודות קריטיות בצמיחה זו.
צוות חוקרים מהמרכז לחקר החיים ומערכות אקולוגיות, מכון למדע מולקולרי, ומספר אוניברסיטאות ביפן—בהן אוניברסיטת נגויה סיטי, אוניברסיטת נגויה ואוניברסיטת צוקובה—חשף מנגנון חדש מאחורי צמיחת סיבי עמילואיד β (Aβ), הקשורים באופן הדוק למחלת האלצהיימר. בעזרת מיקרוסקופיה אטומית-כוחית מהירה (HS-AFM), הם הצליחו לצפות בזמן אמת בצמיחת סיבי Aβ ברמת המולקולה. תגלית זו מספקת תובנה חדשה לגבי אופן היווצרות הסיבים ומגלה דרכים אפשריות לעצור את התקדמותם.
מחלת האלצהיימר היא מחלה נוירודגנרטיבית המשפיעה על הזיכרון והתפקוד הקוגניטיבי. אחד המניעים המרכזיים שלה הוא הצטברות חלבוני Aβ במוח, אשר מצטברים יחד ויוצרים סיבים שמפריעים לתפקוד המוח התקין. הבנת מנגנון הצמיחה של סיבים אלה וכיצד ניתן לעכב את היווצרותם היא קריטית לפיתוח טיפולים חדשים, אך עד כה המנגנונים הספציפיים שהובילו לצמיחתם היו קשים להבנה.
התארכות והשהייה לסירוגין של סיבי עמילואיד בטא
תהליך ההתארכות וההשהייה לסירוגין של סיבי עמילואיד β (Aβ) תועד על-ידי שילוב של מיקרוסקופיה אטומית-כוחית מהירה (HS-AFM) עם סימולציות מונטה קרלו. המחקר חשף את המנגנון שבו הנוגדן 4396C נקשר באופן סלקטיבי למצב "מושהה" של צמיחת הסיב, ובכך מונע התארכות נוספת של סיבי Aβ. קרדיט: המחברים.
תובנות לגבי מנגנון צמיחת הסיבים
החוקרים גילו שכל סיב Aβ מורכב משני גדילים דקים, הנקראים פרוטופילמנטים. הפרוטופילמנטים גדלים בדפוס לסירוגין, כאשר מולקולות Aβ נוספות לכל קצה של הגדילים אחת אחת. תגלית קריטית במחקר הייתה שכאשר קצות שני הפרוטופילמנטים מסתנכרנים, הסיב נכנס למצב "מושהה", שבו הצמיחה נעצרת באופן זמני. עיכוב זה בצמיחה הוא שלב מרכזי בתהליך היווצרות סיבי Aβ ויכול להיות המפתח להבנת התקדמות מחלת האלצהיימר.
אחת התגליות המשמעותיות ביותר הייתה תפקידו של הנוגדן 4396C, הנקשר באופן סלקטיבי לקצות סיבי Aβ במצבם המושהה. ברגע שהנוגדן נקשר, הסיב ננעל במצב זה וצמיחה נוספת נמנעת. תגלית זו מציעה גישה חדשה ומבטיחה לעצירת צמיחת סיבי Aβ ובכך להאט את התקדמות מחלת האלצהיימר.
השלכות עתידיות ותחזיות טיפוליות
התצפיות המפורטות שנעשו בעזרת HS-AFM אפשרו לצוות המחקר לחשוף את מנגנון הצמיחה והשהיה לסירוגין, אשר לא זוהה בעבר. על-ידי התמקדות במצב המושהה של סיבי Aβ, המחקר פותח אפשרויות חדשות לפיתוח טיפולים שעשויים לעכב או לעצור את מחלת האלצהיימר ברמה המולקולרית.
בעתיד, מתכנן הצוות לחקור לעומק את פעולת הנוגדן 4396C, מתוך תקווה ליישם את הממצאים הללו לפיתוח גישות טיפוליות חדשות למחלת האלצהיימר. בנוסף, התגלית עשויה להיות רלוונטית למחלות נוספות הקשורות להצטברות חלבונים, שכן התובנות שהושגו מהמחקר עשויות לשפר את הטיפולים למגוון מצבים הכוללים הצטברות חלבונים.
עוד בנושא באתר הידען:

2 תגובות
חשבתי שהתיאוריה לפיה שיבי העצילואיד הם *הסיבה* למחלת האלצהיימר (ולא תוצאה שלה) הופרכה זה מכבר.
א. זה לא נחקר כעובד בתאי אדם.
ב. גם אם זה יעבוד זה לא הפתרון הסופי לאלצהיימר יש עוד הרבה סיבות למחלה.
יש עוד דרך ארוכה…