מדעני המכון מחפשים את הגנים האחראיים להתפתחות המוח

בתהליך ההתפתחות של העובר ברחם הופך גוש שבו מספר תאים לבעל-חיים שלם ומתפקד. אחד ההיבטים המרתקים של תהליך זה מתחולל במוח: מיליארדי תאים נוצרים, נודדים למיקומם המדויק, שולחים שלוחות המקשרות אותם עם תאים נוספים, ובסופו של דבר יוצרים את מכונת הפיקוד והבקרה המאפשרת לנו להניע את איברינו, לראות, לחשוב ולהרגיש. נדידת תאי העצב ממרכז המוח כלפי חוץ היא שאחראית למבנה השכבתי של קליפת המוח, וליכולתם של האותות העצביים לנוע בין השכבות השונות, ובינן לבין המבנים שבעמקי המוח. תוך כדי הנדידה מתבגרים התאים ועוברים שינויים פנימיים וחיצוניים: תא העצב ה"מצולע" (רב-קוטבי) לובש צורה מוארכת ולא-סימטרית (דו-קוטבית), בעלת כיוון מוגדר ושלוחות אופייניות.
שינוי הצורה מהווה חלק מרכזי באירועים רבים הקשורים בהתפתחותה של מערכת העצבים המרכזית. הנדידה והשינויים המתחוללים במהלכה מתאפשרים הודות לשורה ארוכה של אמצעי עזר – החל בתאים מיוחדים היוצרים "מסילות" עליהן נעים תאי העצב, ועד מנגנונים תוך-תאיים שמטרתם למשוך את התא – ובעיקר את הגרעין הכבד – במהלך הנדידה. לצורך כך חלים שינויים בחלבונים היוצרים את השלד התוך-תאי, התומך במבנה התא: המבנה הקשיח והיציב מוחלף בשלד גמיש ודינמי המאפשר תנועה. הבקרה על כל התהליכים האלה נעשית על ידי גנים, אשר שולטים באופן מדוקדק בתזמון ובמיקום של האירועים השונים. שיבושים במנגנוני הבקרה עשויים לגרום מחלות כמו סכיזופרניה, מחלות מוח ניווניות, ו"תסמונת המוח החלק" (lissencephaly), המאופיינת במוח נטול קמטים וקפלים, וגורמת לפיגור קשה ולמוות בגיל צעיר.
פרופ' אורלי ריינר, מהמחלקה לגנטיקה מולקולרית במכון ויצמן למדע, מחפשת את הגנים האחראים להתפתחות המוח. חיפושיה אחר מועמדים מתאימים הובילו אותה באחרונה להתמקד בגן Par1 המקודד את המידע הדרוש לבנייתו של אנזים אשר ממלא תפקיד בקביעת הכיווניות של תאי עצב, וגם מווסת את השינויים בקשיחות השלד של תאים אלה (הוא גורם לניתוקם של חלבונים הצמודים לשלד, וכתוצאה מכך מגביר את גמישותו). מעורבותו של האנזים Par1 באירועים אלה העלתה את החשד, כי הוא מבקר באופן פעיל את נדידת תאי העצב במהלך ההתפתחות העוברית. מחקר שתוצאותיו פורסמו באחרונה בכתב-העת המדעי Journal of Neuroscience מראה, כי האנזים אכן ממלא חלק מרכזי בבקרת הנדידה, וכי הימצאות כמות מתאימה שלו היא עניין קריטי – הן עודף של Par1 והן חוסר בו מזיקים להתפתחות המוח – אם כי בדרכים שונות.
בשלב ראשון של המחקר, שערכה ד"ר תמר ספיר יחד עם תלמידות המחקר סיוון ספוזניק, דנית פינקלשטיין וענת שמואלי, וטכנאית המעבדה טליה לוי, ביקשו החוקרות לבחון מה קורה כאשר מונעים את פעילותו של Par1 במוח העובר המתפתח. לצורך כך השתמשו בשיטה שפיתחה ד"ר ספיר: הן הזריקו מולקולות אר-אן-אי קצרות (siRNA) לחלל שבקליפת המוח של עוברי העכברים. לאחר מכן העבירו זרם חשמלי המאפשר את חדירת המולקולות לתוך תאי העצב הסמוכים לחלל. מולקולות האר-אן-אי נקשרות לגן Par1 ומפריעות לתהליך התרגום שלו לחלבון פעיל. כך למעשה הן מונעות את פעילותו. בנוסף אליהן, מוזרק גן המייצר חומר פלואורסנטי, המאפשר לזהות את התאים בהם נקלטו המולקולות, ולעקוב אחר תנועתם. התהליך מתבצע ביום ה-14 להריון, בו הנדידה מגיעה לשיאה. לאחר ארבעה ימים, בהם נמשכת ההתפתחות העוברית באופן רגיל ברחם, נבדקים מוחות העכברים.
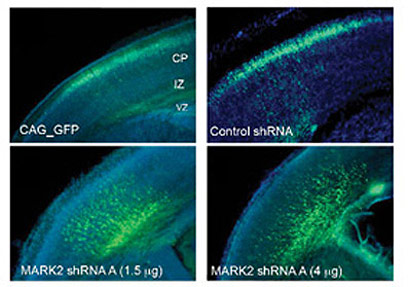
החוקרות גילו, כי פגיעה בגן Par1 מעכבת את נדידת תאי העצב: בעוד שבעכברי הביקורת הגיעו התאים המסומנים עד לשכבה החיצונית של קליפת המוח, בעכברים בהם הושתק הגן "נתקעו" תאי העצב במחצית הדרך. עצירת התאים התרחשה במיקום מוגדר – בו מתרחשים השינויים במבנה תאי העצב, והם רוכשים את הכיווניות שלהם. בהמשך ניסו החוקרות להחזיר לתאי העצב את היכולת לנדוד באמצעות החדרת הגן Par1 בשיטות של הנדסה גנטית. החדרת הגן אכן הצליחה לחלץ את תאי העצב התקועים, אולם רק כאשר הוא ניתן במינון מדויק – ריכוזים גדולים מדי גרמו להיווצרות תאים מעוגלים, חסרי שלוחות, האופייניות לתאי עצב.
בסדרת ניסויים נוספת בדקו החוקרות כיצד בדיוק משפיע Par1 על יכולת הנדידה. התברר, כי פגיעה בגן מגבירה את יציבותו וקשיחותו של השלד התוך-תאי, מה שמקשה על תנועת התא. בנוסף לכך, נפגעת תנועתו של הצנטרוזום – מבנה המהווה חלק מהשלד התוך-תאי, שתפקידו "למשוך" את התא הנודד ברציפות קדימה. נראה, שכתוצאה מפגיעה בגן Par1 נעשתה תנועת הצנטרוזום איטית, וחסרת כיוון מוגדר.
"הנדידה והשינוי המבני הם תהליכים השלובים זה בזה", אומרת פרופ' ריינר. "הממצאים שלנו מצביעים על כך ש-Par1 הוא החוליה המקשרת בין שני התהליכים. הוא עושה זאת באמצעות בקרה כפולה – על כיווניות התא, ועל הדינמיקה של השלד התוך-תאי". פרופ' ריינר מקווה, כי הבנה מעמיקה של הגורמים המווסתים את נדידת תאי העצב, ושל ההתרחשויות המלוות אותה, תסייע בעתיד להתמודד עם מחלות הנגרמות מארגון לא תקין של מבנה המוח. מידע כזה יהיה חיוני, בין היתר, לצורך פיתוח שיטות ריפוי עתידיות המבוססות על הזרקת תאי עצב בריאים לתוך מוח החולה, והכוונתם המדויקת של התאים לאיזור הפגוע.

3 תגובות
לא עולה לי הגייטיאיי
המבין:
מה בדיוק אתה מבין?
אתה יכול להצביע על מאמר קודם שבו האמור כאן מופיע כבר?
חחח
נו מה יהיה?
מה יהיה הסוף עם שיחזורי הניסויים האלה?
אין כאן שום חידוש.
די לחזור על ניסויים שבוצעו לפני שנים!
מכון ויצמן נא להתעשת,תעיפו ת'נקבות האלה מתקני המחקר ותתחילו להתקדם!