החוקרים ממכון ויצמן, יחד עם שותפים מבוסטון וצרפת, מצאו לראשונה תסמונת נוירולוגית הנובעת ממחסור בגן lncRNA בשם "צ'ייסר" – פריצת דרך באבחון מחלות נדירות
התגלתה תסמונת גנטית חדשה הנגרמת מפגם בגן שאינו מקודד לחלבון. המסע לגילויה התפרש על פני יבשות והתבסס על מאגרי מידע שיתופיים המציעים תקווה חדשה בעידן הדיגיטלי.
אמה ברודבנט נולדה לפני תשע שנים בדאלאס עם תווי פנים ייחודיים. כבר בלידתה היא סבלה מחולשת שרירים וממצוקה נשימתית ואת השבועות הראשונים לחייה העבירה ביחידה לטיפול נמרץ. הרופאים שלא הכירו את מחלתה הפנו אותה לריצוף אקסום (Exome) – הליך אבחון גנטי שהפך לנפוץ בשנים האחרונות, גם בישראל. בבדיקה זו מתמקדים ב-1% מהדי-אן-אי שמכיל את האזורים המקודדים לחלבונים, שכן אלה אחראים למרבית המחלות הגנטיות הידועות. ואולם, בדיקה זו לא העלתה דבר, ואמה המשיכה לסבול מעיכוב התפתחותי ומפרכוסים.
אובדי עצות, צירפו ההורים את הפעוטה לרשת של מחלות לא מאובחנות (, נפרס מסעם של מדעני מכון ויצמן למדע ועמיתיהם מרחבי העולם עד לגילוי פורץ הדרך של מחלה גנטית ראשונה הנגרמת מחוסר בעותק של גן שאינו מקודד לחלבון. "מרבית האבחונים הגנטיים כיום עדיין מתעלמים מלינק-אר-אן-אי", אומר פרופ' אוליצקי מהמחלקות לאימונולוגיה ורגנרציה ביולוגית ולנוירוביולוגיה מולקולרית במכון. "המחקר מדגיש עד כמה חשוב להמשיך את החיפוש אחר הגורם למחלות מסתוריות גם בין אלפי הגנים שאינם מקודדים לחלבונים".
הקשר הצרפתי ועיקרון זהבה
לאחר שנוצר הקשר הראשוני ב-2019, החלו שיחות זום חודשיות בין חוקרים ברחבי העולם ובין בריאן ברודבנט, אביה המסור של אמה. המדענים הדגישו בפניו את הקושי ללמוד ממקרה בודד, אך פריצת דרך חשובה התרחשה ב-2021, כשהתקבל מייל מקבוצת מחקר צרפתית שנתקלה במקרה בילד נוסף שהיה חסר לו עותק של הגן. שנה לאחר מכן, נמצא מקרה שלישי בצרפת, ואף שתחילה נדמה היה שהמקרים אינם דומים, שיחת זום גורלית שינתה את התמונה.
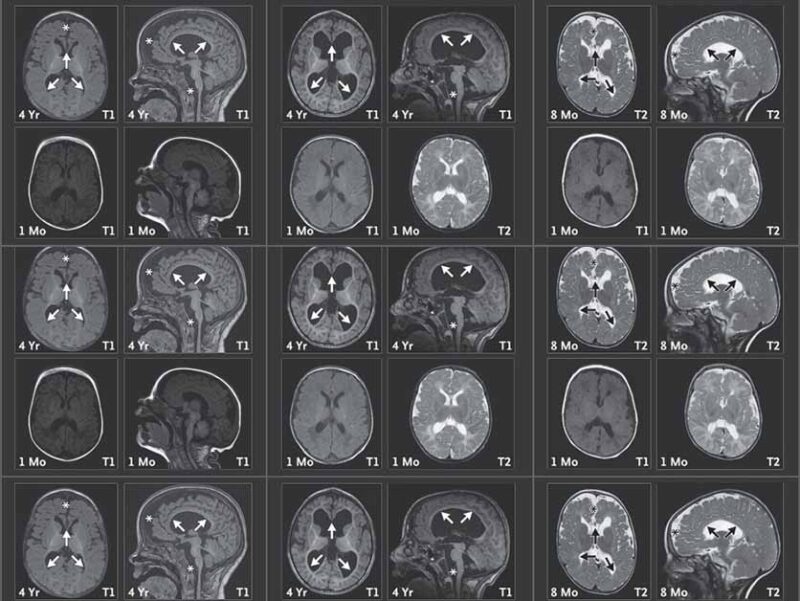
"בשיחה השתתפו החוקרים ומשפחות הילדים ונעזרנו בפוסט-דוקטורנטית מצרפת שעבדה בבוסטון שיכלה לתרגם מצרפתית לאנגלית", מתאר פרופ' אוליצקי. "בפעם הראשונה שהמשפחות ראו זו את זו הן זיהו מיד שלילדיהן מאפיינים דומים מבחינה נוירולוגית וגם דמיון פיזי. בדיקות מעבדה הראו כי בתאיהם של הילדים, כמו שראינו בעכברים, מצטברות רמות גבוהות של CHD2. סריקות MRI הראו כי בשנים הראשונות לחיי הילדים ישנה פגיעה מחריפה בחומר הלבן במוח, שאחראי לעדן ולדייק את העברת האותות בין תאי העצב. כעת לכל משפחה יש אבחנה – תסמונת עיכוב שכלי התפתחותי ואפילפסיה הנגרמת מעותק חסר של הגן צ'ייסר – ויש להן גם קשר לעוד משפחות שמתמודדות עם המחלה. ועדיין, לא יהיה סוף טוב לסיפור עד שנמצא טיפול".
עוד טרם התגלתה התסמונת החדשה, היה כבר ידוע שמחסור בחלבון CHD2 קשור למקרים של אוטיזם ואפילפסיה. כעת התברר שגם ייצור עודף של החלבון מוביל למחלה, וזו אף קשה יותר, שכן הילדים הסובלים ממנה מרותקים לכיסא גלגלים ללא יכולת לתקשר במלים, או לאכול בעצמם. הגילוי החדש הבהיר לחוקרים שהחלבון הוא מקרה מובהק של "עיקרון זהבה" – כמו גיבורת סיפור הילדים זהבה ושלושת הדובים הבוחרת בדייסה שאינה חמה מדי ואינה קרה מדי, גם הרמות של החלבון CHD2 חייבות להישמר בטווח מוגדר כדי להבטיח התפתחות תקינה, וכל סטייה מטווח זה עלולה להיות הרת גורל. עיקרון זה אינו ייחודי ל-CHD2, ובשנים האחרונות מתגלים עוד ועוד חלבונים חיוניים שרמתם עוברת כיוונון מדויק.
מדוע זו בעיה? כי מאתגר למצוא טיפול שביכולתו לכוונן במדויק רמות של חלבונים. "למחלה החדשה עדיין אין לנו פתרון, אך עבור התסמונת הנגרמת מחסר בביטוי של CHD2 אנו מפתחים טיפול שגורם לחסימה חלקית של צ'ייסר", אומר פרופ' אוליצקי. "הטיפול גורם למעשה לכך שהאר-אן-אי המשועתק מהגנים צ'ייסר ו-CHD2 יתאחה למולקולה אחת. במצב המאוחה צ'ייסר פחות פעיל ומיוצר יותר חלבון CHD2. כיום מרבית הלוקים באפילפסיה מטופלים בתרופות נגד פרכוסים ולא בטיפולים המכוונים לשורש הבעיה. גילוי הגורם הגנטי לתסמונות אפילפסיה יוכל לאפשר בעתיד טיפולים ממוקדים יותר".
במחקר השתתפו גם ד"ר קווין ריקין, ד"ר ברטרנד איזידור, ד"ר אליסה פנגם, ד״ר סטפן ביזו ופרופ' בנג'מין קוניה מאוניברסיטת נאנט, צרפת; ד"ר ניקולס צ'טרון ופרופ' דמיאן סנלאוויל מאוניברסיטת ליון 1, צרפת; ד"ר קיי-מארי למאר, מרים ס. עזיז, ד"ר אסתר יון ופרופ' ג'מה ל. קארוויל מאוניברסיטת נורת'ווסטרן, שיקגו; פאולין מונין מבית החולים האוניברסיטאי Hospices Civils de Lyon, צרפת; מלאני או'לירי, ד"ר ג'וליה ק. גודריץ', ד"ר קירן ו. גרימלה, ד"ר אליינה אינגלנד, בן ויסבורד, ד"ר פרנסואה אגה, פרופ' דניאל ג. מקארתור ופרופ' אן אודונל-לוריא ממכון ברוד של MIT והרווארד בקיימברידג', מסצ'וסטס; פרופ' קרלוס א. באצ'ינו, פרופ' דיוויד ר. מרדוק, פרופ' הונגז'אנג דאי, פרופ' ג'יל א. רוזנפלד, פרופ' ליסה ט. אמריק ופרופ' שמיקה כתקר מקולג' לרפואה "ביילור", יוסטון, טקסס; יעל סרוסי מהמחלקה לאימונולוגיה ורגנרציה ביולוגית במכון; וד"ר סאימה קייאני מהמרכז הרפואי של אוניברסיטת טקסס סאות'ווסטרן בדאלאס.
עוד בנושא באתר הידען:
