חוקרים ממכון ויצמן מספקים מידע חדש על ההבדלים התלת-ממדיים בין שני סוגי הצברים של החלבון p53: הרווח שבין רצפי הקישור גורם לשני זוגות ה-p53 להסתובב זה ביחס לזה
עילותו נעשית באמצעות בקרה ישירה על התבטאותם של גנים: כאשר התא נמצא במצב מצוקה המחייב תגובה, כמו חשיפה לרעלים או לקרינה, p53 מופעל ונקשר לאתרי מטרה מוגדרים על גבי הדי-אן-אי – כלומר לתחום מסוים של הרצף הגנטי. כך הוא יכול לשלוט בקצב בו יהפכו גנים אלה לחלבונים פעילים, ולמעשה, הוא יכול לקבוע את תגובת התא למצב החירום.
"אחת התעלומות הגדולות היא, כיצד מצליחים חלבונים כמו p53 לזהות את אתרי המטרה שלהם – רצף קצר של בסיסים- במולקולות הדי-אן-אי שאורכן שלושה מיליארד בסיסים, ולעשות זאת באופן מדויק ותוך זמן קצר ביותר", אומרת פרופ' ציפי שקד, ראש המחלקה לביולוגיה מבנית שבפקולטה לכימיה במכון, אשר חוקרת בשיטות קריסטלוגרפיות את המבנים התלת-ממדיים שיוצר p53 כשהוא קשור לאתרי המטרה שלו על גבי הדי-אן-אי.
במקרה של p53 מדובר בתעלומה כפולה ומכופלת, שכן חלבון זה מכיר מספר גדול של אתרי מטרה, שלכל אחד מהם רצף די-אן-אי מיוחד, זאת מפני שהוא נדרש לווסת את פעילותם של גנים רבים. בנוסף לכך, כאשר התא נכנס למצוקה, p53 ניצב בפרשת דרכים בה הוא נדרש "לבחור" בין שני כיווני פעולה עיקריים: כיוון אחד, במקרה שנגרם לדי-אן-אי נזק קל יחסית, הוא עצירת תהליכי חלוקת התא והפעלת המנגנונים שאחראים על תיקון הנזק. כיוון שני, במקרים בהם הנזק הגנטי אינו ניתן לתיקון, הוא הפעלת גנים אשר מוציאים לפועל את תוכנית ההתאבדות התאית (אפופטוזיס), במטרה לשמור על שלמות הייצור כולו. בכל אחת משתי האפשרויות מפעיל p53 גנים שונים, באמצעות קשירה לאתרי מטרה מיוחדים, שכל אחד מהם מחולל רצף אירועים המפעיל חלבונים שמטפלים במצב בצורות שונות. כיצד נעשית הבחירה בין שתי האפשרויות? רמז אפשרי לפתרון השאלה הזאת מצוי אולי באופן בו נקשר p53 לאתרי המטרה השונים. מחקרים רבים הראו, שאתרים אלה מורכבים משני רצפי קישור (באורך של 10 זוגות בסיסים כל אחד), שאליהם נקשרות ארבע מולקולות של p53. בשנת 2006 הצליחה קבוצת המחקר של פרופ' שקד לראשונה ליצור גבישים של רביעיות של p53 כשהן קשורות לרצפי די-אן-אי שונים, ולפענח את המבנים התלת-ממדיים שלהם.
ממצאי המחקר, שהתפרסמו בכתב העת Molecular Cell, הראו כי שני זוגות של חלבוני p53 נקשרים לשני רצפי הדי-אן-אי זה בסמוך לזה, ויוצרים צבר (complex) מרובע. עוד התגלה, כי אתרי מטרה מרצפים שונים מקיימים דפוסים שונים של אינטראקציות עם ה-p53: חומצות האמינו המצויות באזור הקישור של החלבון מסתובבות על צירן בהתאם לרצף הדי-אן-אי שאליו הן נקשרות, כדי להיצמד אליו בצורה החזקה ביותר. במחקרים שנעשו בהמשך, בקבוצות מחקר נוספות, התברר כי על אף שבכל המקרים נקשרות ארבע מולקולות חלבון לדי-אן-אי, אפשר לחלק את הצברים לשני סוגים מרכזיים, בהתאם לאתרי המטרה שלהם: בסוג הראשון, שני רצפי הקישור מופרדים על-ידי רצף של זוגות בסיסים באורך לא קבוע. בסוג השני לא קיימת הפרדה, ושני הרצפים צמודים זה לזה. עוד התברר, כי אתרים מהסוג השני, הצמוד, ממוקמים לפני גנים שקשורים בעצירת חלוקה, ואילו אתרים מהסוג הראשון, המופרד, נמצאים לפני גנים המוציאים לפועל את תוכנית האפופטוזיס.
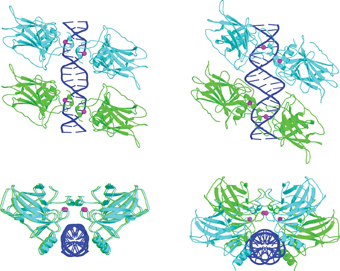
במבנים הגבישיים שחקרה קבוצתה של פרופ' שקד ב-2006 היו אתרי המטרה מהסוג המופרד, ולכן הועלו מספר שאלות: האם קיימים הבדלים בסידור המרחבי של צברי p53 עם אתרי המטרה השונים? אם כן, מה משמעותם של ההבדלים האלה, וכיצד הם משפיעים על יחסי הגומלין בין החלבונים לבין הדי-אן-אי? והאם יש להם תפקיד בהחלטה לאיזה מסלול יש להפנות את התא הפגוע? פרופ' שקד וחברי קבוצת המחקר שלה – החוקרת הבתר-דוקטוריאלית ד"ר מלכה קיטיינר, עמית המחקר ד"ר חיים רוזנברג, תלמיד המחקר עודד סואד, ופרופ' דב רבינוביץ – חקרו סוג חדש של גבישים, שבהם p53 קשור לאתרי מטרה מהסוג הצמוד. הממצאים שלהם, שהתפרסמו באחרונה בכתב העת Nature structural and molecular biology, מספקים מידע חדש על ההבדלים התלת-ממדיים בין שני סוגי הצברים: הרווח שבין רצפי הקישור גורם לשני זוגות ה-p53 להסתובב זה ביחס לזה.

"השינוי הקטן-לכאורה הזה מוביל לשינוי מוחלט בארכיטקטורה של הצבר, בזיקה של החלבון לדי-אן-אי, וביכולת הגישה של חלבונים נוספים להצטרף למבנה. למעשה, זה הבדל של עולם ומלואו", אומרת פרופ' שקד. בעוד שעל אתר המטרה מהסוג הצמוד מסתדרת רביעיית החלבונים בשני זוגות מקבילים, בצורת מקבילית מישורית, על אתר המטרה מהסוג הלא-צמוד הם יוצרים צורת מקבילית מפותלת (ראו איור). בצורה הצמודה, קשרי הגומלין בין ארבעת החלבונים חזקים הרבה יותר, המבנה יציב הרבה יותר, והזיקה לדי-אן-אי חזקה יותר. כאשר הזיקה חלשה יותר, נדרשים חלבונים נוספים כדי לייצב את המבנה. ייתכן כי חלבונים נוספים כאלה מעורבים בהחלטה אם לנסות לתקן נזקים, או להשמיד את התא.
כשבחנו המדענים את זוגות הבסיסים בזה אחר זה, הם גילו הבדל מעניין נוסף בין שני אתרי המטרה. מתברר כי באתרים חסרי הרווח, בסיסי הדי-אן-אי מסוג אדנין מסובבים ב-180 מעלות ביחס לבני זוגם מהגדיל המקביל, בסיסי תימין, ויוצרים מבנה מיוחד. חישובים שעשו מדענים מאוניברסיטת קולומביה בניו יורק הראו, כי משיכה חשמלית חזקה תורמת ליציבות הגדולה יותר של המבנים מהסוג הזה. "התגלית הזאת מרחיבה את אפשרויות הקריאה הידועות של רצף הדי-אן-אי – לא רק בהקשר ל-p53, אלא גם לגבי חלבונים דומים נוספים", אומרת פרופ' שקד. "מתברר כי בנוסף למידע המצוי ברצף הבסיסים, קיים אלף-בית נוסף, הטמון בזווית שבין הבסיסים, אשר מרחיב עוד יותר את אפשרויות הזיהוי של הצופן הגנטי".
בקבוצת הביולוגיה המבנית של p53 משתתפים גם ד"ר נעמה קסלר, ד"ר יעל דיסקין-פוזנר, אמיר אלדר, אביבה קפיטקובסקי ויעקב חלפון.

2 תגובות
קודם כל זה כן נבדק.
דבר שני מאחר ולחלבונים יש אורך חיים מוגבל וכל הזמן הם נוצרים ועוברים פרוק, גם אם נוצר חלבון לא תקין הנזק שהוא יגרום קטן יחסית. לעומת זאת ה-DNA הוא התוכנה ואם הוא משתנה הנזק הוא תמידי.
כל הזמן מדברים על פגיעה ב DNA על ידי רעלים או קרינה דבר הגורם למוטציות ולנזקים ב DNA הזקוק לתיקון או להשמדה.
אך מה עם פגיעה בחלבוני העזר כמו ה P53 אפילו שהוא נוצר באופן תקין, פגיעה יותר מאוחרת בו מקרינה או רעלים גורמת לנזקים כאילו הגן היוצר אותו היה פגום ואז הוא לא ממלא את תפקידו כראוי,לדעתי מספיק בחלבון אחד או כמה שלא עושים את תפקידם כראוי כדי ליצור תאים ממאירים שלא כתוצאה מפגם בגנים היוצרים אותם.
נכון שמדובר פה בזמינות לנזק, חלבונים שמתחלפים מהר לעומת DNA שהוא קבוע אבל עדיין יש לבדוק גם הבט זה.