הבנת מנגנון הפעולה עשויה להשפיע על הטיפולים בסרטן ובהיפר-פיגמנטציה
חוקרים בטכניון "תפסו על חם" את פעילותו של האנזים טירוזינאז ברמה המולקולרית, וזאת באמצעות מיכשור מתקדם של קריסטלוגרפיה בקרני X. כך מדווח השבוע כתב העת Nature Communications.
במחקר מעורבות שתי פקולטות טכניוניות: הפקולטה להנדסת ביוטכנולוגיה ומזון והפקולטה לכימיה ע"ש שוליך. במעבדתה של פרופ"ח אילת פישמן, בפקולטה להנדסת ביוטכנולוגיה ומזון, מתמקדים בהבנת הקשר בין מבנים של אנזימים לתיפקודם. אחד האנזימים הללו הוא טירוזינאז, הנפוץ בכל רמות החיים: במיקרו-אורגניזמים, בצמחים ובחיות. הוא אחראי על השלבים הראשונים בייצור הפיגמנט הכהה מלנין. בגוף האדם נמצא הטירוזינאז בתאי מלנוציטים באפידרמיס, והמלנין הנוצר לא רק קובע את צבע העור, השיער והרשתית, אלא גם ממלא תפקיד חשוב בהגנה מפני קרינת UV. מוטציה באנזים זה היא הסיבה העיקרית לאלביניזם (לבקנוּת), המוביל להפרעות ראייה ולרגישות לקרינה. בפירות וירקות גורמת פעילות הטירוזינאז להשחמה, והתוצאה היא נזק כלכלי למְגַדלים.
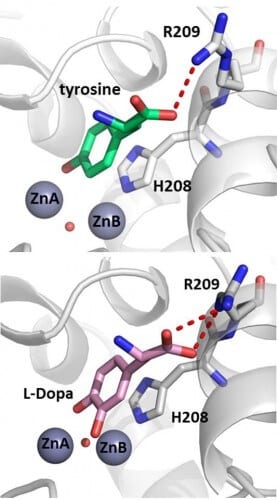
הטירוזינאז מבצע שתי תגובות-חימצון עוקבות: הפיכתן של מולקולות אורגניות קטנות (כגון חומצת האמינו טירוזין) לדי-פנול, ואחריה הפיכת הדי-פנול לקווינון (quinone), המאפשר את יצירת המלנין. האנזים זקוק לשני יוני נחושת, והדעה המקובלת בקהילה המדעית היתה שכל אחת משתי התגובות מתרחשת על יון נחושת אחר.
מור גולדפדר, דוקטורנטית בהנחיה משותפת עם פרופסור נעם אדיר מהפקולטה לכימיה ע"ש שוליך, והפוסט דוקטורנטית ד"ר ריטה קנטייב, השתמשו בקריסטלוגרפיה של קרני-X על מנת לפתור לראשונה את המבנה של טירוזינאז חיידקי בנוכחות של שני הסובסטרטים: המונו-פנול טירוזין, והדי-פנול דופה (L-Dopa). בנוסף, הן הצליחו לפתור מבנה עם סובסטראט נוסף, שבו ניתן היה לראות בבירור את התוצר הקטליטי של האנזים בעת היווצרותו. הדוקטורנטית סיון יששכר-עובדת, אשר חוקרת שימושים של האנזים במזון, היתה שותפה למחקר. התוצאות מוכיחות שכל הסובסטרטים מיוצבים בצורה זהה לחלוטין באתר הפעיל של האנזים, ופונים רק אל אחד מיוני הנחושת.
הבנה של מנגנון הפעולה והמבנה של הטירוזינאז עשויה לסייע בטיפול בהיפר-פיגנטציה ובכתמי זיקנה, בשיפור רגישותם של תאי מלנומה לטיפול בקרינה, ובמניעת השחמה בפירות וירקות.
