צוות בינ"ל של חוקרים ובהם גם מהאוניברסיטה העברית, זיהו 331 גנים קריטיים להתמיינות נוירונלית, והצביעו על PEDS1 כגורם להפרעה נוירו-התפתחותית
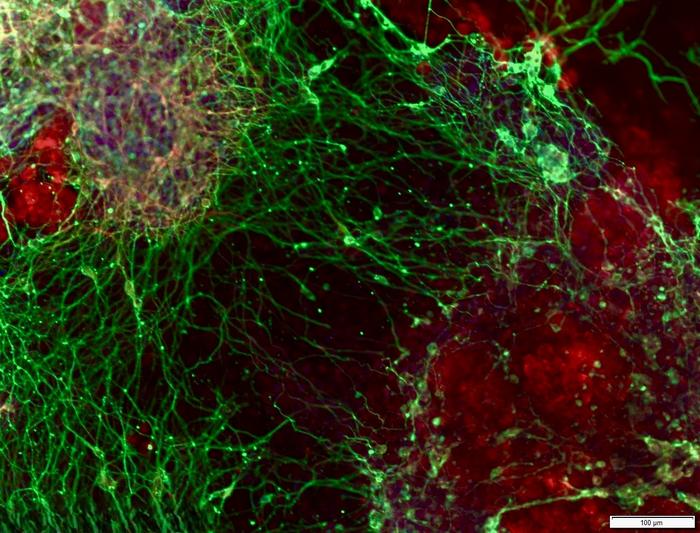
הפרעות נוירו-התפתחותיות (כגון עיכוב התפתחותי, חלק מהמקרים של הפרעות בספקטרום האוטיסטי ומיקרוצפליה) נובעות לעיתים משיבושים המתרחשים בשלבים מוקדמים ביותר של התהליך שבו תאי גזע עובריים עוברים התמיינות לתאי עצב. עם זאת, קיים אתגר מדעי משמעותי: למערכת העצבים מסלולים מרובים, חפיפות פונקציונליות ותזמונים התפתחותיים מורכבים, ורבים מהגנים המעורבים בתהליכים אלו טרם זוהו. יתרה מכך, גם כאשר מזוהה "גן חשוד" בבדיקות גנטיות, קשה להוכיח שהוא אכן מניע את הפנוטיפ ואינו מופיע כממצא מקרי.
במחקר חדש שפורסם בכתב העת Nature Neuroscience, צוות מחקר בינלאומי בהובלת פרופ' שגיב שיפמן ממכון למדעי החיים באוניברסיטה העברית בירושלים, בשיתוף עם פרופ' בינאז ילצ'ין מ-INSERM שבצרפת, מציע גישה מערכתית: במקום חיפוש אחר גן בודד בכל פעם, ביצוע מיפוי שיטתי של הגנים שנוכחותם הכרחית על מנת שתאי גזע יעברו בהצלחה את מסלול ההתמיינות הנוירונלי.
מתודולוגיית המחקר: מסך CRISPR רחב היקף
הצוות המחקרי, הכולל חוקרים מישראל, צרפת ויפן, ביצע מסך CRISPR בסדר גודל חסר תקדים: כיבוי מכוון של כ-20,000 גנים בתאי גזע עובריים של עכבר, ולאחר מכן מעקב אחר יכולתם לעבור התמיינות לתאי עצב תפקודיים. כך התאפשר זיהוי מדויק של "כיבויים" הגורמים לכשל בתהליך, ובאילו שלבים ספציפיים. התוצאה המרכזית היא זיהוי של 331 גנים שהתגלו כחיוניים ליצירת נוירונים, כאשר רבים מהם לא נקשרו בעבר באופן ישיר להתמיינות עצבית.
דפוס דומיננטי מול רצסיבי: תובנה מנגנונית
אחת התובנות המדעיות המעניינות היא שהגנים הקשורים להפרעות בעלות דפוס תורשה דומיננטי (שבהן עותק פגום אחד מספיק לביטוי המחלה) נוטים להיות מועשרים בתפקידים של ווסת שעתוק — כלומר תפקידי "ניהול" של תוכניות גנטיות בתא. לעומת זאת, גנים הקשורים להפרעות רצסיביות (הדורשות שני עותקים פגומים) מראים נטייה למעורבות במסלולים מטבוליים. אמנם חלוקה זו אינה פותרת את מלוא המורכבות, אך היא מספקת מסגרת מושגית: כאשר מתגלה מוטציה חדשה בבדיקה קלינית, ניתן לשאול האם היא נמצאת בקטגוריה "ניהולית" או "מטבולית", ומה זה מעיד על המנגנון הפתופיזיולוגי.
מהמעבדה למרפאה: הסיפור של PEDS1
הנקודה הבולטת במחקר היא זיהוי תפקיד חדש עבור הגן PEDS1, המעורב בייצור פלסמלוגנים — ליפידים מיוחדים בממברנות התא, הידועים כחשובים במיוחד במערכת העצבים ובמיאלין. במסך, החוקרים מצאו ש-PEDS1 ממלא תפקיד חשוב ביצירת תאי עצב, וכי אובדנו מוביל לגודל מוח מופחת.
משם עברו החוקרים לשלב קליני: חיפוש מוטציות ב-PEDS1 במשפחות, וזיהוי מוטציה נדירה ב-PEDS1 בשתי משפחות לא קשורות, אצל שני ילדים עם הפרעה התפתחותית חמורה המאופיינת בעיכוב התפתחותי ובמוח קטן יותר. על מנת לחזק את הקשר הסיבתי, החוקרים כיבו את PEDS1 במודלים ניסויים. הניסויים אישרו ש-PEDS1 הכרחי להתפתחות מוח תקינה, כולל יצירה והגירה של תאי עצב, ממצאים העשויים להסביר את התכונות הקליניות שנצפו אצל הילדים שנפגעו.
פרופ' שגיב שיפמן מהפקולטה למתמטיקה ומדעי הטבע באוניברסיטה העברית מסביר: "על ידי מעקב אחר התמיינות תאי גזע עובריים לתאי עצב ושיבוש שיטתי של כמעט כל הגנים בגנום, יצרנו מפה של הגנים החיוניים להתפתחות המוח. מפה זו יכולה לעזור לנו להבין טוב יותר כיצד המוח מתפתח ולזהות גנים המקושרים להפרעות נוירו-התפתחותיות שטרם התגלו. זיהוי PEDS1 כגורם גנטי לליקוי התפתחותי בילדים, והבהרת תפקידו, פותח את הדלת לאבחון משופר וייעוץ גנטי למשפחות, ועשוי בסופו של דבר לתמוך בפיתוח טיפולים ממוקדים".
מפת "חיוניות" להבחנה בין אוטיזם לעיכוב התפתחותי
מפת ה"חיוניות" של הצוות, המראה מתי נדרשים גנים במהלך ההתפתחות, עזרה גם להבהיר הבדלים בין המנגנונים העומדים בבסיס אוטיזם ועיכוב התפתחותי. גנים שהם חיוניים באופן רחב נמצאו בקשר חזק יותר לעיכוב התפתחותי, בעוד שגנים שהם קריטיים באופן ספציפי במהלך שלבי יצירת תאי העצב נמצאו בקשר חזק יותר לאוטיזם. ממצא זה עוזר להסביר כיצד שיבושים במסלולים שונים יכולים להוביל לתסמינים חופפים.
צוות המחקר והנגישות למדע
המחקר כלל תרומות מפרופ' תמר הראל, ד"ר גליה מונדרר-רוטקוף, עלנה עמלן, אהד סלים ואלעד דביר מהאוניברסיטה העברית, בנוסף לשיתוף פעולה עם חוקרים מצרפת ויפן.
החוקרים הפכו את הממצאים לנגישים באמצעות השקת מסד נתונים מקוון פתוח הכולל את מלוא תוצאות מסך ה-CRISPR. פרופ' שיפמן ייחס את היוזמה לסטודנטית לדוקטורט עלנה עמלן: "רצינו שהממצאים שלנו ישרתו את כלל הקהילה המדעית".
מגבלות ושיקולי פרשנות
יש לזכור שמדובר במערכת מודל (תאי גזע והתמיינות במעבדה, ומסך בעכבר). המוח האנושי מורכב יותר, וכולל תהליכים של ארגון רקמתי ותזמונים התפתחותיים ארוכים שאינם משוחזרים במלואם במודלים אלו. לפיכך, התרגום לפרקטיקה הקלינית צריך להיעשות בזהירות. עם זאת, עצם המתודולוגיה "מסך רחב היקף → רשימת גנים מועמדים → דירוג לפי פונקציה → אימות קליני" מהווה תבנית שיכולה להאיץ את גילוי גורמים גנטיים חדשים להפרעות נוירו-התפתחותיות.
עוד בנושא באתר הידען:
