החוקרים אליסון והונג'ו הראו כיצד אסטרטגיות שונות לשיבוש הבלמים של מערכת החיסון יכולות לשמש בטיפול במחלת הסרטן. התגליות שלהם מהוות ציון דרך במאבק של האנושות כנגד הסרטן
תרגום: ד"ר משה נחמני
פרס נובל לרפואה לשנת 2018 הוענק לשני חוקרים: ג'יימס אליסון מארה"ב וטסוקו הונג'ו (Tasuku Honjo) מיפן עבור התגליות שלהם של ריפוי סרטן באמצעות עיכוב הויסות החיסוני השלילי. מנגנון הריפוי שלהם מבוסס על מעכבי נקודות בקרה של מערכת החיסון (Immune checkpoint inhibitors).
תקציר
מחלת הסרטן גורמת למותם של מיליוני אנשים מדי שנה והיא מהווה את אחד מהאתגרים הגדולים ביותר של האנושות בתחום הרפואה. על ידי המרצת היכולת של מערכת החיסון שלנו לתקוף תאים סרטניים, חתני פרס הנובל לרפואה לשנת 2018 ייסדו רעיון חדש לחלוטין לריפוי סרטן.
ג'יימס אליסון חקר חלבון ידוע המתפקד בתור בלם של מערכת החיסון. הוא הבין את הפוטנציאל של שחרור הבלם וכתוצאה מכך שחרור התאים החיסוניים שלנו המשמשים להיאבק בגידולים. בשלב הבא, הוא הצליח לקדם את הרעיון החדש הזה שלו לכדי גישה חדשה לחלוטין לשם טיפול בחולי סרטן.
בד בבד, טסוקו הונג'ו גילה חלבון הפועל על תאי מערכת החיסון, ולאחר בדיקות מדוקדקות של תפקודיו, הוא גילה בסופו של דבר שגם הוא משמש בתור בלם של מערכת החיסון, אך כזה הפועל בעזרת מנגנונים אחרים. שיטות ריפוי המבוססות על התגלית שלו הוכחו כיעילות במיוחד עבור הטיפול כנגד מחלת הסרטן.
החוקרים אליסון והונג'ו הראו כיצד אסטרטגיות שונות לשיבוש הבלמים של מערכת החיסון יכולות לשמש בטיפול במחלת הסרטן. התגליות שלהם מהוות ציון דרך במאבק של האנושות כנגד הסרטן.
האם ניתן לרתום את מערכת החיסון שלנו לשם טיפול בסרטן?
ההגדרה של סרטן כוללת בתוכה מחלות שונות רבות, שכולן מאופיינות בהתרבות בלתי מבוקרת של תאים לא בריאים ובעלי יכולת להתפשט לאיברים ורקמות בריאים אחרים. מספר גישות ריפוי זמינות לטיפול בסרטן, לרבות ניתוחים, הקרנות, וגישות אחרות, שחלקן הובילו לזכייה בפרסי נובל קודמים. אלו כוללות בתוכן שימוש בהורמונים לשם טיפול בסרטן הערמונית (Huggins, 1966), כימותרפיה (Elion and Hitchins, 1988) והשתלת מח עצם לטיפול בלוקמיה, סרטן הדם (Thomas 1990). עם זאת, סרטן מתקדם נשאר קשה מאוד לטיפול, ואסטרטגיות טיפוליות חדשניות נדרשות באופן נואש.
בשלהי המאה התשע-עשרה ובתחילת המאה העשרים, הגיח הרעיון כי שפעול מערכת החיסון עשוי לשמש כאסטרטגיה יעילה למאבק בתאים סרטניים. כתוצאה מכך, נעשו ניסיונות להדביק חולים בחיידקים שונים על מנת לשפעל את מערכת ההגנה. מאמצים אלו הובילו להצלחות צנועות במיוחד, אולם גרסה של שיטה זו משמשת כיום במסגרת הטיפול בסרטן של שלפוחית השתן. הקהיליה המדעית הגיעה למסקנה כי יש צורך בידע נוסף. מדענים רבים החלו לעסוק במחקר בסיסי נרחב בתחום זה תוך גילוי מנגונים יסודיים המבקרים את מערכת החיסון וגם הראו כיצד מערכת החיסון יכולה לזהות תאים סרטניים. למרות התקדמות מדעית ראויה לציון, ניסיונות לפתח שיטות חדשות וכלליות כנגד מחלת הסרטן הוכחו כמאתגרות במיוחד.
מאיצים ובלמים במערכת החיסון שלנו
המאפיין היסודי של מערכת החיסון שלנו הוא יכולתה להבדיל בין רכיבים "עצמיים" לבין רכיבים "זרים" הנמצאים בתוך הגוף שלנו, כך שיהיה ניתן לתקוף ולהעלים פולשים שונים לתוכו, כגון חיידקים, נגיפים ומזיקים אחרים. תאי טי, סוג של תאי דם לבנים, נוטלים תפקיד מפתח במערכת הגנה זו. נתגלה כי תאי טי אלו כוללים קולטנים הנקשרים למבנים זרים תוך כדי הפעלת מערכת החיסון. אולם, נמצא כי נדרשים גם חלבונים נוספים המתפקדים כמאיצי תאי טי על מנת להפעיל את מלוא עוצמתה של מערכת החיסון (ראו איור). מדענים רבים תרמו למחקר בסיסי חשוב זה וזיהו חלבונים אחרים המתפקדים בתור בלמים לתאי הטי, תוך עיכוב ההפעלה של מערכת החיסון. שיווי משקל מורכב זה בין הפעילות של מאיצים לבין הפעילות של בלמים חיוני לשם השגת בקרה מדויקת. שיווי משקל זה מבטיח כי מערכת החיסון פועלת באופן יעיל כנגד מיקרואורגניזמים זרים בעודה נמנעת מלהגיע להפעלת-יתר העלולה להוביל להרס חיסוני של תאים ורקמות בריאים.
רעיון חדש עבור ריפוי בעזרת מערכת החיסון
במהלך שנות התשעים, במעבדתו שבאוניברסיטת קליפורניה, ברקלי, ג'יימס אליסון חקר את חלבון תאי הטי בשם CTLA-4. הוא היה אחד ממספר מדענים שהבינו כי חלבון זה (CTLA-4) מתפקד בתור בלם לפעילותם של תאי טי. צוותי מחקר אחרים ניצלו את המנגנון הזה בתור יעד לטיפול במחלות אוטו-חיסוניות. לאליסון, לעומת זאת, היה רעיון שונה לחלוטין. בשלב זה הוא כבר פיתח נוגדן שיכול להיקשר לחלבון CTLA-4 ולמנוע את פעילותו (ראו איור). כעת הוא חקר האם הפעילות של CTLA-4 תוכל לנתק את הבלם שעל תאי הטי ולהפעיל את מערכת החיסון כך שתוכל לתקוף תאי סרטן. אליסון וצוות המחקר שלו ביצעו את הניסוי הראשון בשלהי שנת 1994, והתוצאות שלהם היו מדהימות – עכברים עם סרטן נרפאו בעקבות טיפול בנוגדנים המעכבים את הבלם ומפעילים מחדש את הפעילות של תאי טי. למרות עניין מועט במחקר זה מצידה של תעשיית הרוקחות, אליסון המשיך במאמציו הנרחבים במטרה לקדם את האסטרטגיה ולהפוך אותה לטיפול רפואי באדם. תוצאות מבטיחות החלו להתפרסם מטעמם של מספר קבוצות מחקר, ובשנת 2010 הוליד מחקר קליני חשוב תוצאות מבטיחות במיוחד בחולים עם מלנומה (סוג של סרטן העור) מתקדמת. במספר מטופלים נעלמו לחלוטין סממנים לנוכחותו של הסרטן. תוצאות מדהימות שכאלו מעולם לא נצפו לפני כן בקבוצת חולים זו.
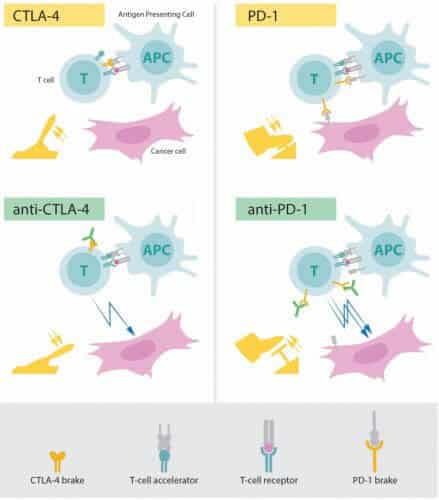
חלק שמאלי תחתון: נוגדנים (ירוק) הפועלים על החלבון CTLA-4 מונעים את הפעילות של הבלם תוך הפעלת תאי הטי המסוגלים לתקוף את תאי הסרטן.
חלק ימני עליון: החלבון PD-1 מתפקד גם הוא בתור בלם של תאי טי המעכב את הפעילות של תאי הטי.
חלק ימני תחתון: נוגדנים הפועלים על החלבון PD-1 מונעים את הפעילות של הבלם תוך הפעלת תאי הטי המסוגלים לתקוף את תאי הסרטן.
המחשה: וועדת פרס נובל
הגילוי של החלבון PD-1 וחשיבותו לריפוי סרטן
בשנת 1992, מספר שנים לפני הגילוי של אליסון, החוקר טסוקו הונג'ו גילה את החלבון PD-1, חלבון נוסף המתבטא על פני השטח של תאי טי. במטרה לחשוף את תפקידו של חלבון זה, החוקר בדק באופן דקדקני את פעילותו בסדרה של ניסויים אלגנטיים שנערכו במשך שנים רבות במעבדתו שבאוניברסיטת קיוטו. התוצאות הראו כי החלבון PD-1, בדומה לחלבון CTLA-4, מתפקד בתור בלם לתאי טי, אולם פועל במנגנון שונה. במסגרת ניסויים בבע"ח, נצפה כי הבלימה של החלבון PD-1 מהווה גם היא אסטרטגיה מבטיחה לשם מאבק בסרטן, כי שהוכח על ידי הונג'ו ועל ידי קבוצות מחקר אחרות. גילויים אלו סללו את הדרך לשימוש בחלבון זה כיעד לטיפול בחולי סרטן. לאחר הפיתוח הקליני של חלבון זה, מחקר מפתח שנערך בשנת 2012 הראה יעילות מוכחת בטיפול בחולים עם סוגי סרטן שונים. התוצאות היו דרמטיות – נצפתה נסיגה ארוכת טווח ואפילו ריפוי מלא אצל מספר חולים עם סרטן מפושט, מצב שנחשב בעבר כבלתי ניתן לטיפול.
ריפוי סרטן כיום ובעתיד בעזרת נקודות בקרה של מערכת החיסון
לאחר המחקרים הראשוניים שהוכיחו את פעילות הבלימה של החלבונים CTLA-4 וכן PD-1, הפיתוח הקליני שלהם הפך לדרמטי. כיום ידוע שהטיפול בגישה זו, המכונה בשם 'ריפוי בעזרת נקודות בקרה של מערכת החיסון', שינה מן היסוד את יעילות הריפוי עבור קבוצות חולים מסוימות עם סרטן מתקדם. בדומה לשיטות ריפוי סרטן אחרות, גם כאן נצפו תופעות לוואי, שעלולות להיות חמורות ואפילו מסכנות חיים. תופעות אלו נגרמות על ידי תגובה חיסונית ביתר המובילה לתגובות אוטו-חיסוניות, אולם בדרך כלל ניתן לטפל בהן ביעילות. המחקר הנרחב והמתמשך בתחום זה מתמקד כיום בהבנת מנגנוני הפעילות, זאת במטרה לשפר את יעילות הטיפולים תוך צמצום תופעות הלוואי.
מבין שתי גישות הטיפול, ריפוי בעזרת נקודות בקרה של מערכת החיסון תוך שימוש בחלבון PD-1 הוכח כיעיל יותר, זאת בעקבות קבלת תוצאות חיוביות בסוגי סרטן שונים, לרבות סרטן ריאות, סרטן כליות, לימפומה ומלנומה. מחקרים קליניים מעודכנים מצביעים על כך שריפוי משולב, כלומר ההפעלה של שני החלבונים יחדיו, עשוי להיות אפילו יעיל יותר, כפי שנצפה בחולים עם מלנומה. לפיכך, שני החוקרים אליסון והונג'ו סיפקו השראה עבור המאמצים לשלב שיטות שונות במטרה לשחרר את הבלמים הפועלים על מערכת החיסון, זאת בכדי לחסל תאים סרטניים באופן יעיל יותר. מספר רב של ניסויים רפואיים במסגרת שיטות ריפוי המבוססות על גישה זו נערכים כיום כנגד מרבית סוגי הסרטן, וחלבונים חדשים מקבוצה זו נבדקים ונחקרים במטרה לבדוק את יעילותם כיעדים לריפוי כזה.
יותר מלמעלה ממאה שנים שמדענים מנסים לרתום את מערכת החיסון במטרה להיאבק במחלת הסרטן. עד לחשיפת התגליות שאחראים להן שני חתני פרס הנובל לשנת 2018, ההתקדמות בפיתוח הקליני של ריפוי סרטן הייתה איטית. הרעיון של 'ריפוי בעזרת נקודות בקרה של מערכת החיסון' הביא לפריצת דרך בתחום של טיפול במחלת הסרטן ושינה מן היסוד את האופן שבו אנו מטפלים בגידולים סרטניים.
עוד בנושא באתר הידען:

2 תגובות
אישתי החלה לקבל טיפול בתרופה החדשה לטענת הרופאים לפני התרופה החדשה היא לא הייתה שורדת יותר מכמה חודשים.היא רק החלה בטיפול כך שעדיין אין תוצאות .דרך אגב היא חלתה בסרטן רמה 4 בכליה בכבד בריאה ובלימפה .נקווה שהטיפול יצלח .מי שרוצה עצה איפוא לטפל ושאר פרטים יכול להתקשר אלי 039708344 עובד .אני גר בלאס וואגס.
איך עברו מעל 20 שנים ועדיין לא נותנים את זה כטיפול לאנשים שגם ככה על סף מוות.. אפילו אם הטיפול יהרוג אותם, מזה משנה כבר