חוקרים הדגימו שיטה חדשנית להעברת פרודות פעילות ביולוגית קטנות, חלבונים ודנ"א ישירות לתוככי תאים חיים באמצעות "ננו-סילונים" כימיים, המנקבים חרירים זעירים במעטפת ההגנה של התאים
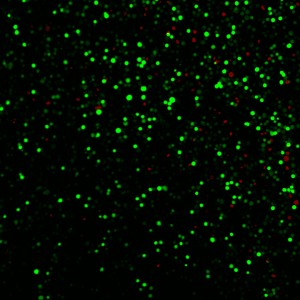
ננו-חלקיקי פחמן, המשופעלים ע"י פרצי אלומת לייזר, יוצרים את הסילונים הזערוריים ואלה, בתורם, גורמים לפתיחת חרירים בקרומית התא לפרק זמן המספיק לשם החדרת חומרים רפואיים המצויים בנוזל החוץ-תאי לתוככי התא. ע"י התאמת זמן החשיפה לאלומת הלייזר, החוקרים הצליחו להחדיר תרכובת-סמן קטנה לתשעים אחוזים מתאי מטרה – תוך כדי שמירת פעילותם הבריאה של יותר מתשעים אחוזים מהתאים.
המחקר, שבוצע בחסות המכונים הלאומיים לבריאות בארה"ב ((NIH ומכון מחקר ב- Georgia Tech. , פורסם בכתב-העת המדעי Nature Nanotechnology.
שיטה זו תאפשר לנו להעביר מגוון נרחב של חומרים רפואיים שכיום די קשה להחדירם לתוככי התאים," אמר Mark Prausnitz, פרופסור בביה"ס להנדסה כימית וביומולקולארית במכון הטכנולוגי של ג'ורג'יה. "אחד מהיישומים החשובים ביותר של טכנולוגיה זו יוכל להיות בפיתוח שיטות ריפוי מבוססות גנים, המספקות תקווה כבירה ברפואה, ואשר ההתקדמות שלהן עוכבה בשל הקושי להחדיר דנ"א או רנ"א לתוככי התאים."
נטען כי שיטה זו הינה הראשונה המשתמשת בשפעול ננו-חלקיקי פחמן פעילים באמצעות לייזר עבור יישומים רפואיים. עדיין יידרשו מחקר וניסויים רפואיים נוספים טרם הכנסתה של השיטה לטיפול בבני-אדם.
מזה עשורים שמדענים מנסים להחדיר דנ"א ורנ"א לתוככי התאים באופן יעיל יותר ויותר באמצעות מגוון שיטות, בכללן השימוש בנגיפים כאמצעי-העברה של חומרים גנטיים, ציפוי דנ"א ורנ"א בחומרים כימיים או באמצעות הפעלת שדות חשמליים וגלים על-קוליים לשם ביקוע קרומיות התאים. אולם, שיטות אלו סבלו מיעילות ירודה או חששות בטיחותיים לאדם.
השיטה החדשנית, המבוססת על עבודה קודמת של צוות חוקרים שגילה את מה שכונה על-ידם כתוצא הפוטו-קולי ("photoacoustic effect"), מתחילה בהחדרת ננו-חלקיקי פחמן (בגודל של 25 ננומטרים) לתוך הנוזל החוץ-תאי המקיף את התאים, ואשר בו יימצאו החומרים הרפואיים. בשלב הבא מופעלים על הנוזל פרצי קרינה תת-אדומה-קרובה מלייזר פמטושניות בקצב של 90 מיליוני פעימות בשנייה.
ננו-חלקיקי הפחמן סופגים את האנרגיה ובעקבות כך מתחממים. החלקיקים החמים גורמים לאחר-מכן לחימום הנוזל המקיף אותם והפיכתו לאדים. האדים החמים מגיבים עם ננו-חלקיקי הפחמן ליצירת הגזים מימן ופחמן חד-חמצני. שני הגזים יוצרים בועית ההולכת וגדלה כל עוד היא מקבלת אנרגיה מהלייזר המופעל. כאשר מכבים את הלייזר הבועית קורסת מידית ויוצרת גל-הדף המנקב חרירים בקרומיות התאים הסמוכים. ניקוב זה מאפשר את חדירתם של חומרים רפואיים המצויים בנוזל החוץ-תאי לתוככי התא. החרירים הזעירים נסגרים מהר וכך התא מסוגל לחיות ולהישאר פעיל.
החוקרים הדגימו כי הם מסוגלים להחדיר את חומר-הסמן Calcein, את החלבון אלבומין שבנסיוב היונקים ודנ"א פלסמידי דרך קרומיות תאים אנושיים של סרטן הערמונית ותאי-חולדות הנגועים בגידולים ממאירים באמצעות השיטה החדשנית. ספיגת הסמן Calcein אובחנה בתשעים אחוזים מהתאים כאשר הלייזר הופעל ברמות ששימרו בחיים תשעים אחוזים מהם.
"הראנו שכמעט כל התאים מסוגלים לספוג לתוכם את החומרים הללו, שבאופן רגיל לא חודרים לתא, ושכמעט כל התאים נותרו בחיים," מסביר אחד מהחוקרים. "מערכת ננו-חלקיקי הפחמן שלנו, המשופעלים באמצעות לייזר, מאפשרת קריסה מבוקרת של בועיות הגורמת לניקוב קרומיות התא במידה כזו המאפשרת חדירה של החומרים מבלי לגרום נזק לתאים עצמם."
בכדי לבדוק לכמה זמן נוצרים החרירים ע"ג קרומית התא, החוקרים ניקבו תאים מבלי שהיו בסביבתם החומרים הרפואיים, המתינו שנייה אחת לאחר כיבוי הלייזר, ואז הוסיפו אותם למערכת. הם גילו כי כמעט ולא התאפשרה חדירה של החומרים הפעילים, מה שמרמז שקרומיות התאים "אטמו" את עצמן במהירות.
בכדי לאמת את ההשערה כי תגובת האידוי של חלקיקי הפחמן היא הגורם המכריע ביצירת ננו-הסילונים, החוקרים החליפו אותם בננו-חלקיקי זהב לפני הפעלת קרינת הלייזר. ננו-חלקיקי הזהב גרמו לספיגה מועטה ביותר של החומרים הפעילים, וזאת בשל העובדה כי הם לא הכילו את הפחמן הדרוש לתגובה עצמה. באופן דומה, החוקרים ניסו את השיטה שלהם עבור ננו-שפופרות פחמן במקום ננו-חלקיקים וגם במצב זה מדדו ספיגה מועטה בלבד, וזאת בשל העובדה כי ננו-שפופרות פחות פעילות מננו-חלקיקי פחמן.
ניסויים נוספים הראו כי פרודות דנ"א אכן מצליחות לחדור לתא בשיטה זו ונותרות פעילות בו, ומסוגלות לגרום לביטוי חלבונים בתא. כאשר הוחדר לתאי סרטן דנ"א פלסמידי המקודד לביטוי החומר לוציפראז (luciferase), הייצור שלו גדל בשבעה-עשר סדרי גודל.
בשלבים הבאים של המחקר המדענים מתכוונים לבחון את יעילות השיטה גם בשימוש בלייזר ננו-שניות, שהינו פחות יקר מציוד הפמטו-שניות המשמש אותם כיום. כמו-כן, הם מתכוונים לשפר את ננו-חלקיקי הפחמן כך שכמעט כולם יגיבו במהלך החשיפה לקרינת הלייזר. אומנם ננו-חלקיקים אלו לא אמורים לסכן את בריאות האדם, אולם ייתכן והגוף לא יוכל להפריש אותם מתוכו, מציין החוקר.
"זהו המחקר הראשון אי-פעם המוכיח את העיקרון של שפעול ננו-חלקיקי פחמן באמצעות לייזר לשם העברת תרופות וגנים," אמר החוקר. "עדיין נותרה דרך ארוכה לפני ששיטה זו תוכל לשמש ברפואה יומיומית, אולם אנו אופטימיים ביותר שגישה זו תוכל, בסופו של דבר, לספק חלופה חדשה להעברת חומרים רפואיים לתוככי התאים באופן יעיל ובטוח."
