חסימות והצרות של כלי דם הן גורם ראשון במעלה למחלות נפוצות כמו יתר לחץ דם, התקפי לב ושבץ, המהוות גורם מרכזי לתמותה בעולם המערבי

חסימות והצרות של כלי דם הן גורם ראשון במעלה למחלות נפוצות כמו יתר לחץ דם, התקפי לב ושבץ, המהוות גורם מרכזי לתמותה בעולם המערבי. צברים של שומן "מתיישבים" על דפנות העורקים, מצמצמים את זרימת הדם בהם, ובכך מונעים אספקת חמצן ומזון. הטיפול המקובל כיום לסתימות ב"צנרת" הוא פתיחה של ה"סתימה" באמצעות תרופות או תומכן (סטנט), או החלפה של ה"צינור" באמצעות ניתוח. במעבדה של ד"ר קרינה יניב במכון ויצמן למדע נוקטים גישה אחרת, כדי לנסות למנוע את הסתימה מראש.
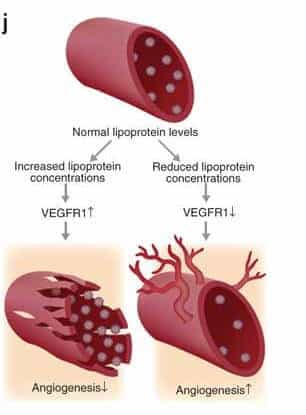
רמות גבוהות של LDL (משמאל) מגדילות את כמות הקולטן המדומה לגורם הגדילה VEGF, וכך פוגעות בצמיחה ובחיוניות של כלי הדם. רמות נמוכות של LDL (מימין) מקטינות את כמות הקולטן המדומה, וכך תורמות לצמיחה של כלי דם.
כדי לעשות זאת, יש להבין במדויק כיצד נוצרות החסימות. בניגוד לצינור במטבח הביתי, אין מדובר בהצטברות פאסיבית של שומנים על דפנותיו. כלי הדם – כפי שגילתה ד"ר יניב – מסוגלים לחוש בשומנים המצויים בזרם הדם, ואף להגיב ולשנות את התנהגותם בהתאם לכמותם ולסוגם. למעשה, התהליך בו נוצרים גושי שומן על דפנות כלי הדם מתקיים תוך כדי דו-שיח בין תאי האנדותל, שמדפנים את כלי הדם, לבין צברי השומן. כתוצאה מדו-שיח זה, מאפשרים תאי האנדותל לצברי השומן לחצות את השכבה הפנימית של ה"צינור", ולהתמקם בנוחות בצדה החיצוני – שם נוצר גוש שומן שלוחץ על הדפנות וגורם להצרתן, וכך מוביל להתפתחות מחלות כלי דם.
במחקר שהתפרסם בכתב-העת המדעי Nature Medicine חשף צוות מדענים, בראשות ד"ר יניב מהמחלקה לבקרה ביולוגית, כיצד מושפעים תאי האנדותל מרמת השומנים שבדם. כדי שיוכלו להינשא בזרם הדם, ארוזים השומנים במעין חלקיקים, אשר מכילים גם מולקולות חלבון ש"מחזיקות" אותם, ובהמשך מאפשרות את כניסתם לתאי הגוף. חלקיקים אלו, הקרויים Lipoproteins (חלבוני-שומן), נושאים גם כולסטרול, ומחולקים לשני סוגים עיקריים: LDL("כולסטרול רע"), ו-HDL ("כולסטרול טוב"). המחקר הנוכחי התמקד בחלקיקי LDL. בחלקיקים אלה כמות השומנים גדולה ביחס לכמות החלבון, והם ידועים כגורם סיכון מדרגה ראשונה להתפתחות מחלות כלי דם. "הרפואה מתייחסת רק לרכיבים השומניים שב-LDL, אך המחקר שלנו מראה, כי דווקא החלבון שמצוי בחלקיק ממלא תפקיד מכריע בדו-שיח עם תאי האנדותל", אומרת ד"ר יניב.
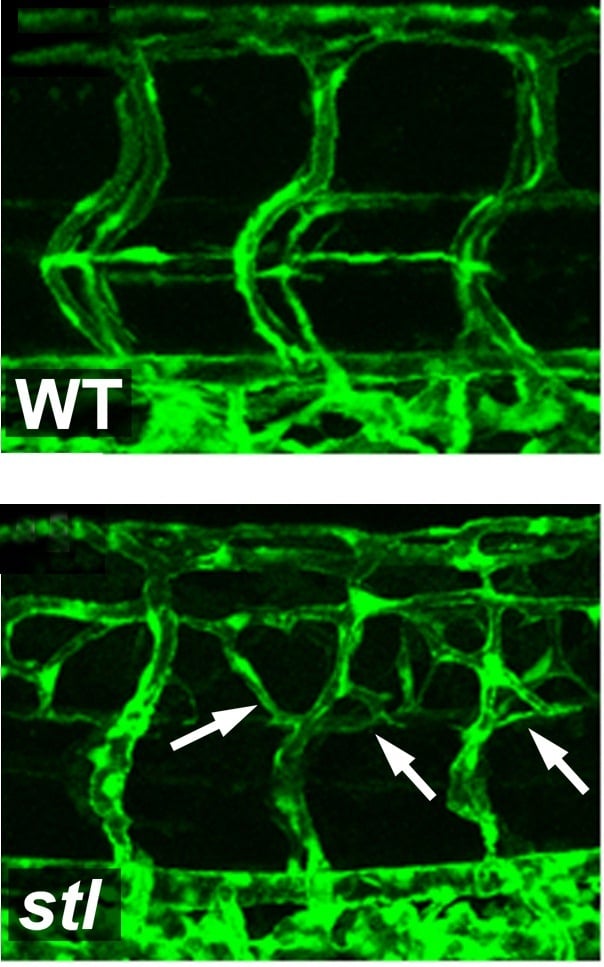
תצלום מיקרוסקופי של כלי דם בעוברי דג זברה. בדג המכיל המוטציה (בתמונה התחתונה) נוצרת צמיחה מוגברת של כלי דם, לעומת עובר דג רגיל (בתמונה העליונה)
בשלב הראשון של המחקר, שנעשה בעוברים של דגי זברה, גילו החוקרים מוטציה הגורמת לייצור עודף של כלי דם – כמעט כפול מבדגים רגילים. התברר, כי הגן שנפגע אחראי לאריזה ולהפרשה של חלקיקי ה-LDL: הוא מחבר מולקולות שומן לחלבון נשא הקרוי ApoB, ומשגר את החלקיק המוכן לזרם הדם. כאשר הגן נפגע, הדגים אינם מייצרים "כולסטרול רע". מוטציה דומה קיימת גם בבני אדם. אנשים אלה אינם מייצרים LDL, ואינם סובלים ממחלות לב הקשורות לעודף שומנים בדם – כמו טרשת עורקים.
כיצד בדיוק משפיע החוסר ב-LDL על תאי האנדותל שבכלי הדם? המדענים גילו, כי ירידה ברמת ה"כולסטרול הרע" מובילה לחלוקה מוגברת של תאי אנדותל, ואילו עלייה ברמת ה-LDL גורמת לעיכוב ביכולת שלהם להתחלק, לנדוד וליצור כלי דם חדשים. בדיקה מעמיקה חשפה, כי ה-LDL משפיע על תאי האנדותל באמצעות התערבות ישירה במנגנון מרכזי האחראי לחלוקתם – זה המופעל על-ידי גורם הגדילה VEGF. תאי האנדותל מכילים שני סוגי קולטנים לגורם הגדילה: קולטן "רגיל", שבתגובה לקשירת גורם הגדילה מוביל לחלוקה של התא, וקולטן "מדומה", אשר מתחרה עם הקולטן ה"רגיל" על הקישור לגורם הגדילה, אך קשירתו לגורם הגדילה אינה מלווה בתגובה, והוא משמש לבקרה ולוויסות. מתברר, כי רמה גבוהה של LDL גורמת לעלייה ברמת הקולטן המדומה, וכך מובילה לעצירת החלוקה של תאי האנדותל. לעומת זאת, רמות נמוכות של LDL גורמות לחלוקה מוגברת של תאי אנדותל, וליצירת כלי דם חדשים.
ממצאי המחקר מראים, כי החלבון ApoB, המשמש מרכיב ב"כולסטרול הרע", מהווה גורם מתווך מרכזי בהשפעת חלבוני השומן על תאי האנדותל, ובכך מוביל למחלות הקשורות בחסימת כלי דם. הבנת המנגנון שבו גורמים ApoB ו-LDL לפגיעה בתאי אנדותל תאפשר, אולי, בעתיד, להתערב בתהליך זה, ובכך לאפשר יצירת כלי דם שיעקפו את החסימות המסוכנות.

תגובה אחת
ד"ר קרינה יניב את גדולה! – תמיד ידענו את זה….מהרואים