ב־Science Advances הוצגה הבחנה בין עצירת־גדילה מוסדרת ומוגנת לבין עצירה מופרעת ולא יציבה, עם נקודת תורפה במעטפת התא שעשויה לאפשר אסטרטגיות טיפול ממוקדות
אנטיביוטיקה אמורה לחסל חיידקים. בפועל, בזיהומים עקשניים, חלק קטן מהתאים שורד גם בלי מוטציות של עמידות. אחרי שהטיפול נגמר, אותם תאים יכולים “להתעורר” ולגרום להישנות. התופעה הזו נקראת התמדה (antibiotic persistence), והיא אחת הסיבות לכך שחלק מהזיהומים חוזרים למרות טיפול שנראה נכון על הנייר.
מחקר חדש מהאוניברסיטה העברית, שפורסם ב־Science Advances, מציע הסבר פשוט שמיישב ויכוחים ישנים בתחום: לא כל “תאי ההתמדה” דומים זה לזה. למעשה, חיידקים יכולים להגיע לשרידות גבוהה תחת אנטיביוטיקה דרך שני מצבי עצירת־גדילה שונים לחלוטין. ההבדל ביניהם לא רק תאורטי. הוא משנה את השאלה איזה טיפול או שילוב תרופות עשוי לעבוד.
לא רק תרדמה: עצירה “מוגנת” מול עצירה “מופרעת”
במשך שנים ההסבר הדומיננטי היה פשוט: החיידקים נכנסים לתרדמה מבוקרת. אנטיביוטיקות רבות פוגעות בעיקר בתאים שגדלים ומתחלקים. לכן תא “ישן” נפגע פחות.
המחקר החדש מסכים שזה קורה, אבל מוסיף מסלול נוסף. לפי המחברים, שרידות גבוהה יכולה לנבוע משני “ארכיטיפים” של עצירת־גדילה:
האחד הוא עצירה מוסדרת שמביאה למצב רדום ומוגן. השני הוא עצירה מופרעת ולא מוסדרת. זה מצב לא יציב. התא לא “מתגונן בשקט”, אלא נכנס לתפקוד משובש. דווקא שם נמצאות חולשות פוטנציאליות, במיוחד בהקשר של יציבות מעטפת התא.
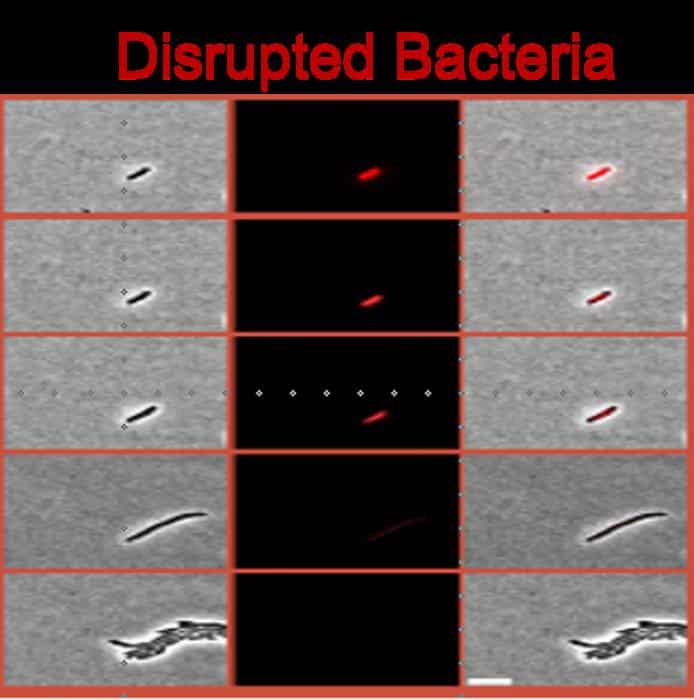
איך הראו שיש כאן שני מצבים שונים
הצוות עבד בעיקר עם E. coli והשווה בין שתי דרכים להביא תרבית לעצירת גדילה.
במצב אחד החיידקים הגיעו באופן טבעי לשלב שבו נגמרים חומרי המזון. במצב השני הוטל עליהם עקה חדה שמדמה רעב פתאומי באמצעות serine hydroxamate (SHX). בשני המקרים, כשהחיידקים נכנסו לעצירה ואז נחשפו לאנטיביוטיקה מסוג בטא־לקטם (כמו אמפיצילין), נראתה סבילות גבוהה ודומה. אבל מכאן והלאה התגלו הבדלים עמוקים.
כדי להבדיל בין המצבים, החוקרים שילבו מודלים מתמטיים עם כמה כלים ניסויים:
תעתוק (transcriptomics) כדי לראות אילו גנים “דולקים” תחת עקה, מיקרוקלורימטריה למדידת חום זעיר שמעיד על פעילות מטבולית, ומיקרופלואידיקה שמאפשרת לעקוב אחרי תאים בודדים לאורך זמן. השילוב הזה הראה ש”עצירה מוסדרת” נוטה להיות יציבה ואחידה יותר בין תאים, בעוד ש”עצירה מופרעת” מאופיינת בשונות גבוהה ובדינמיקה פחות נשלטת.
אחד הממצאים הבולטים: במצב המופרע, החיידקים הראו פגיעה כללית באיזון של מעטפת התא (membrane homeostasis). זו לא עוד “תכונה קטנה”. זו נקודת תורפה שיכולה להפוך ליעד טיפולי.
למה זה יכול לשנות טיפול
המחקר לא מציע אנטיביוטיקה חדשה למדף, אבל הוא מציע דרך לחשוב על אסטרטגיה. אם חלק מהשורדים הם “רדומים מוגנים”, ייתכן שכדאי לנסות לגרום להם לצאת מעצירה מבוקרת ואז לתקוף אותם, למשל באמצעות תנאים שמעודדים חזרה לצמיחה יחד עם אנטיביוטיקה מתאימה. לעומת זאת, אם חלקם נמצאים במצב מופרע שבו מעטפת התא לא יציבה, ייתכן שדווקא שם עדיף לתקוף נקודות חולשה של הממברנה או לבחור שילובים שמנצלים את השיבוש הזה.
בהודעת EurekAlert שמלווה את הפרסום מודגש שהחלוקה לשני “מצבי שרידות” יכולה להסביר למה מחקרים שונים בתחום קיבלו בעבר תוצאות סותרות. לעתים הם פשוט חקרו מצבים פיזיולוגיים שונים מבלי לקרוא להם בשמות שונים.
חשוב להגיד את זה בזהירות: מדובר במסגרת שמחברת בין מנגנון, מדידה והצעה טיפולית. המעבר לזיהומים אמיתיים בגוף ולפרוטוקולים קליניים הוא השלב הבא, והוא לא נבדק כאן ישירות.
עוד בנושא באתר הידען:
