מדעני מכון ויצמן למדע גילו כי הארס של חילזון-ים בשם חרוט ארסי פועל במנגנון שלא היה מוכר עד כה. הממצאים עשויים לסייע בפיתוח תרופות חדשות ליתר לחץ דם ולהפרעות בקצב הלב

בתוך הקונכייה הססגונית של חילזון הים המכונה חרוט ארסי, שוכן טורף קטלני המחסל במהירות וביעילות דגים, תולעים ועוברי אורח אחרים הנקרים בדרכו. במחקר אשר התפרסם באחרונה בכתב-העת המדעי רשומות האקדמיה האמריקאית למדעים (PNAS), חשפו מדעני מכון ויצמן למדע כי הארס שבאמצעותו ממית החרוט הארסי את קורבנותיו, פועל במנגנון שלא היה מוכר עד כה. ממצאים אלה עשויים להסביר חלק מתופעות הלוואי של תרופות החוסמות תעלות אשלגן, כגון תרופות ליתר לחץ דם ולהפרעות בקצב הלב, ולהוביל לפיתוח תרופות שיפעלו בדרכים חדשות.
"מרכיבים מסוימים בארס של החרוט הארסי ממיתים חרקים אך לא יונקים", מספר ד"ר יזהר קרבט, מדען סגל במעבדתו של פרופ' איתן ראובני במחלקה למדעים ביומולקולריים. "יצאנו לדרך במחשבה להשתמש במרכיבים אלה כדי ליצור קוטלי חרקים טבעיים שלא יפגעו בבני-אדם, אך המחקר קיבל תפנית מפתיעה".
חיות ארסיות רבות משתקות את קורבנותיהן באמצעות רעלנים החוסמים את פתח התעלות אשר מובילות יוני אשלגן אל תוך התא ומחוצה לו. תעלות אשלגן אלה הן מנגנונים תאיים חיוניים לוויסות ההולכה של אותות חשמליים בגוף ותהליכים רבים אחרים. חלק מהתרופות ליתר לחץ דם ולהפרעות בקצב הלב פועלות במנגנון דומה לרעלנים אלה, הקרוי "פקק בבקבוק" בשל חסימת פתח התעלה. כאשר החלו ד"ר קרבט ועמיתיו לחקור חרוטים ארסיים, הם בדקו, ראשית, אם הארס שלהם פועל אף הוא בשיטת "הפקק". אך הניסויים במעבדה הראו כי לא מדובר באותו המנגנון.
מרכיבים מסוימים בארס של החרוט הארסי ממיתים חרקים אך לא יונקים. יצאנו לדרך במחשבה להשתמש במרכיבים אלה כדי ליצור קוטלי חרקים טבעיים שלא יפגעו בבני-אדם, אך המחקר קיבל תפנית מפתיעה"

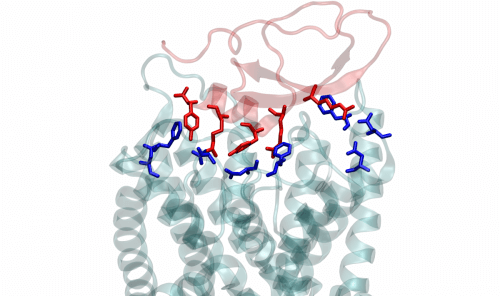
כדי להבין כיצד פועל הארס של החילזון הקטלני, יצרו ד"ר קרבט וחברי קבוצה אחרים, בשיתוף מדענים מאוניברסיטת תל-אביב ומאוניברסיטת דברצן שבהונגריה, גבישים מרעלנים מרכזיים בארס שלו, ופענחו את המבנה התלת-ממדי של גבישים אלה. לאחר מכן ערכו רישום אלקטרופיסיולוגי של פעילות תעלות האשלגן ויצרו מוטציות גנטיות כדי לבחון את אופן הקישור ואת מנגנון השפעת הרעלנים על התעלה. הממצאים העלו כי בניגוד לחוסמי תעלות האשלגן המוכרים, הרעלנים בארס החרוט פועלים על היקף התעלה ולא על פתחה. בהמשך ערכו המדענים הדמיות מחשב באמצעות גרסאות מתקדמות של דינמיקה מולקולרית, טכנולוגיה אשר אפשרה להם לבחון את האינטראקציות בין הארס ובין חלבוני התעלה ברמת האטומים הבודדים. "אחד היתרונות של טכנולוגיה זו הוא שהיא חושפת את המיקום לא רק של מרכיבי מולקולת החלבון, אלא גם של מולקולות מים בודדות ושל יונים", מסביר ד"ר קרבט.
ההדמיות חשפו כי קשרי הגומלין בין חומצות האמינו של הארס ובין אלה של חלבוני התעלה שיבשו את קשרי המימן בתוך התעלה בצורה שהגבירה את זרימת המים בחללים התוך-חלבוניים סביב פתח התעלה. הזרם המוגבר, בתורו, הביא לקריסת הפתח כולו, ובכך מנע ממנו להעביר את יוני האשלגן דרך דופן התא. במלים אחרות, התעלה הפסיקה לפעול, וזרם יוני האשלגן נעצר, אך לא על ידי מנגנון "פקק בבקבוק", אלא באמצעות מנגנון חדש הפועל על היקף התעלה.
תגלית זו שופכת אור חדש על בקרת תעלות אשלגן בתא החי. ידוע אמנם כי תעלות אלה עלולות לקרוס עקב פתיחה ממושכת וזרימת יונים מוגברת – תהליך הקרוי "השתקה איטית" (slow inactivation) – אך המנגנון המולקולרי מאחורי תהליך זה לא היה מוכר. ממצאי המחקר מצביעים על כך כי השתקה איטית נגרמת כנראה מתנועת מים מוגברת ומשינויים מבניים המתרחשים עקב כך בהיקף של פתח התעלה.
הממצאים מציעים גם תובנות חשובות לפיתוח תרופות עתידיות. כך למשל, אפשר יהיה לבדוק אם חלק מתופעות הלוואי של תרופות החוסמות תעלות אשלגן, נגרמות כתוצאה משיבושים מבניים הדומים לאלה הנגרמים על-ידי ארס של החרוט הימי; ואם אכן כך, לפתח תרופות שאינן גורמות את התופעות האלה. הפתחים של תעלות האשלגן נשמרו במהלך האבולוציה – כלומר, יש להם אותו מבנה ואותו הרכב מולקולרי ביצורים ובסוגי תאים שונים. משמעות הדבר היא שתרופה החוסמת את הפתח עלולה להשפיע על כל סוגי התאים בגוף. לעומת זאת, מרכיבי החלבון בהיקף התעלה נבדלים מאוד בין סוגים שונים של תאים ורקמות, ולכן הם יכולים להוות מטרות הרבה יותר ממוקדות לתרופות. "פיתוח תרופות שישפיעו על היקף התעלה ויגרמו לה לקרוס, יכול להיות מכוון נגד קבוצה מוגדרת של תעלות המתבטאות אך ורק בתאים מסוימים", אומר פרופ' ראובני. "הדבר עשוי להקטין את תופעות הלוואי של התרופות".
במחקר השתתפו שחר פיין וד"ר דליה גורדון מהמחלקה למדעים ביומולקולריים של המכון; שלי המר רוגוטנר וד"ר אורלי דים מהמחלקה לתשתיות מחקר מדעי החיים של המכון; חגית אלטמן-גואטה, ד"ר פליקס פרולוב וד"ר מיכאל גורביץ מאוניברסיטת תל-אביב; וטיבור סנטו וד"ר גיורגי פני מאוניברסיטת דברצן.

תגובה אחת
איך החילזון כזה חכם?