מחקר ישראלי: יעילות התיקון של DNA תלויה במרחק בין כרומוזומים
ה-DNA שלנו טומן בחובו את סודות החיים, אבל למרות חשיבותו העצומה מדובר במבנה שברירי מאוד: קרינה, כימיקלים, ואפילו תהליכי החיים הרגילים בתא גורמים לעיתים לשברים של גדילי ה-DNA. את רוב השברים מצליחים מנגנוני התא לתקן בכוחות עצמם, בתהליך שחשיבותו קריטית: תיקון כושל עלול לגרום למותו של התא, או להתפתחות של גידול סרטני. אחד ממנגניני התיקון הנפוצים הוא החלפה (רקומבינציה). התא מחפש במקטע אחר של DNA רצף זהה או דומה לזה שנשבר, מעתיקו ומחליף את הקטע הפגום. אף על פי שתהליך הרקומבינציה מוכר כבר שנים רבות, עדיין לא ברור כיצד הוא פועל, או ליתר דיוק: כיצד התא יודע לחפש ולמצוא רצף חלופי בדיוק כה רב.
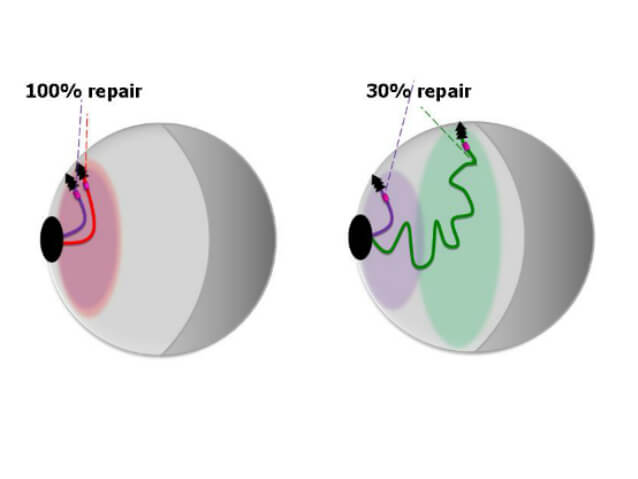
תשובה חלקית מתקבלת מעבודה של חוקרים במחלקה לביולוגיה מולקולרית וביוטכנולוגיה באוניברסיטת ת"א. החוקרים פיתחו שיטה לזיהוי המיקום המרחבי של הכרומוזומים – מארְזי ה-DNA – בתוך התא, וגילו להפתעתם כי לכל כרומוזום יש מיקום קבוע. הם גם גילו עוד כי תיקון ה-DNA יעיל יותר ככל שהכרומוזום התורם את המקטע החלופי קרוב יותר לכרומוזום הפגוע. "מצאנו שהמיקום של הכרומוזומים בתוך גרעין התא קובע את היכולת שלהם לתקן את עצמם", מסביר ראש צוות המחקר, פרופ' מרטין קופייק. "הממצאים שלנו מסבירים גם איך תאים נורמלים מצליחים להימנע מתיקון לא מדוייק של נזקי DNA, באמצעות השתלת רצף מכרומוזום מרוחק, ומעדיפים את התיקון הנכון".
עוברים משמרים לגידולים
פרופ' קופייק ותלמידת המחקר (כיום ד"ר) נטע אגמון, עשו את המחקר בתאי שמרים, הדומים מבחינות רבות לתאים מפותחים יותר, אך יתרונם הגדול שקל יחסית לעשות בהם מניפולציות גנטיות. הם פיתחו שיטות המאפשרות לגרום שבר בנקודה ידועה בכרומוזום, ובחנו את עבודתו של מנגנון התיקון באמצעות רקומביציה. זה נעשה בין השאר בעזרת יצירת רצפי DNA הדרושים לתיקון השבר, והשתלתם במקומות מסויימים בכרומוזומים אחרים. בהמשך הם שיתפו פעולה עם מעבדות ממכון פסטר בצרפת, שם פותחה שיטה המאפשרת לקבל מעין תמונה תלת מימדית של הנעשה בגרעין התא. סימון המרכיבים השונים של התהליך בצבעים זוהרים, מאפשר למדוד במיקרוסקופ את המרחקים ביניהם, ולגלות בדיוק מהיכן נלקח ה-DNA לתיקון השבר בכרומוזום. העבודה פורסמה בכתב העת Nature Cell Biology.
"לממצאים שלנו עשויה להיות חשיבות רפואית רבה", אומר קופייק. היא יכולה לסייע בריפוי מחלות גנטיות באמצעות 'רקומבינציה טיפולית' – החלפת רצף גנים פגום ברצף תקין. היא עשויה לסייע להבנת התפתחותם של גידולים סרטניים בעקבות שיבושים בתהליך הרקומבינציה, ולתרום לייעול טיפולי ההקרנות בחולי סרטן. הטיפולים האלה הורגים תאים סרטניים באמצעות שבירת הכרומוזומים, אך כיום הם פוגעים גם בתאים הבריאים. אם תימצא דרך למנוע את תיקון הכרומוזומים רק בתאים הסרטניים, ההקרנות יהיו יעילות יותר ומזיקות פחות לחולה".
ואולם, בטרם יהיה אפשר לרתום את התהליכים האלה לטיפול בחולי סרטן, יידרשו החוקרים לפענח כמה תעלומות הקשורות למנגנון התיקון של שברי DNA. עדיין לא ברור כיצד יודע המנגנון לקרוא את הרצף הפגום, וכיצד הוא מצליח לחפש – ולמצוא – רצף חלופי בכרומוזומים אחרים. מחקרם של אגמון וקופייק הניב עוד ממצא מעניין. שבר בכרומוזום גורם לגרעין התא להתחיל לרעוד ולרטוט. לדבריהם, אפשר שמדובר במעין מנגנון ערבול שנועד להגדיל את ההסתברות שהאנזים המחפש אכן ימצא ביעילות גבוהה את הרצף המבוקש. וכמובן יש לזכור – תאי השמרים דומים מאוד לתאים שלנו, אבל גם שונים. אפילו כאשר יובן במלואו מנגנון התיקון של ה-DNA, אין לנו שום ערובה שהוא פועל באופן זהה גם בתאים שלנו.
