מדעני מכון ויצמן למדע השתמשו בשיטות חישוביות חדשות כדי לזהות מולקולה בעלת פוטנציאל תרופתי שתמנע מהתא לקבל מסרים מזיקים – מבלי לשבש את מעבר המסרים החיוניים
התאים שלנו מקבלים יותר מסרים מאשר מכשיר נייד של מתבגר ממוצע – וכמו אצל מתבגרים, מוטב היה לסנן חלק מהם. קבוצת המחקר של ד"ר ניר לונדון מהמחלקה לכימיה אורגנית במכון ויצמן למדע, יחד עם עמיתים נוספים, השתמשו בשיטות חישוביות חדשות כדי לזהות מולקולה שתמנע מהתא לקבל מסרים מזיקים – מבלי לשבש את קבלת המסרים החיוניים לתפקודו. ממצאי המחקר פורסמו באחרונה בכתב-העת המדעי Cell – Chemical Biology.
כאשר אות נקלט דרך פני השטח החיצוניים של התא ונכנס פנימה, המידע מועבר באמצעות חלבונים באחד ממסלולי העברת האותות של התא עד הגעתו לגרעין. במרבית המקרים, מדובר במסרים המווסתים את תפקודי הגוף השונים, אבל אותות אלה ממלאים גם תפקיד במחלות – החל בדלקות ומחלות אוטואימוניות ומטבוליות וכלה בגורמי הגידול המשובשים במחלת הסרטן. המסלול שחקרו ד"ר לונדון וקבוצתו, המוכר בראשי התיבות JNK, מתווך, בין היתר, מסרים המחוללים מוות תאי בעקבות הצטברות פלאק במוח במחלת אלצהיימר ומשתתף גם בתהליכים דלקתיים אחרים. מולקולות האיתות במסלול זה – חלבונים מקבוצת הקינאז – מעבירות את מסריהן באמצעות "זרחון" (הוספת קבוצה זרחתית) החלבון הבא בשרשרת. תחילת המסלול עשויה לכלול כמה חלבוני קינאז, הנקראים יחד MAP3K, אך החוליה הבאה מורכבת משני חלבונים בלבד, MKK4 ו-MKK7, אשר מעבירים את המסר לחוליה האחרונה בשרשרת, חלבון JNK – שעל-שמו קרוי המסלול כולו – והוא מעביר את המסר לחלבוני שעתוק אשר "מפעילים" ו"מכבים" גנים בגרעין.
"זו הדרך שבה מסלולי העברת אותות רבים בנויים: הצטמצמות לשני חלבוני קינאז ולאחריהם צוואר בקבוק של חלבון אחד", אומר ד"ר לונדון. "השתמשנו בתכונה זו כדי להתביית על הנקודה המתאימה ביותר לשיבוש תהליך העברת האות לגרעין. תחילת המסלול, המורכבת מחמישה עד עשרה חלבוני MAP3K, מחייבת לחסום את כולם. מנגד, ה-JNK בסוף המסלול ממלא תפקידים בכל תאי הגוף, כך ששיבוש פעולתו יגרור תופעות לוואי משמעותיות. לפיכך חלבוני ה-MKK הם 'חוליית הזהב' בשרשרת. טיפול תרופתי הממוקד באחד מהם עשוי להפחית את פגיעת המסרים המזיקים – מבלי לחסום כליל את המסלול".
מכיוון שהמולקולה נקשרת קוולנטית לקינאז, היא מעכבת את החלבון במשך כל חייו. משמעות הדבר היא שאם המולקולה תוכיח עצמה בניסויים קליניים, היא תוכל להינתן במינונים קטנים או לעתים רחוקות"
החוקרים התמקדו באחד מהחלבונים – MKK7 – קינאז חסר מעכבים מוכרים אשר אין מספיק מחקר על אודותיו, בין היתר, מכיוון שעד כה לא הייתה דרך להפריד את פעילותו מזו של אחיו, MKK4. לשמחתם, הם גילו ב-MKK7 את חומצת האמינו ציסטאין במיקום לא אופייני. היות שציסטאין יכולה ליצור קשרים כימיים חזקים ובלתי הפיכים (במונחים כימיים, קשרים קוולנטיים), תרופה שתיקשר לאתר ספציפי זה תוכל להיות סלקטיבית מאוד, כלומר לגרום תופעות לוואי מועטות ביותר.
בעבר, פיתח ד"ר לונדון שיטה חישובית לגילוי תרכובות כימיות המעכבות חלבונים בצורה קוולנטית. השיטה מאפשרת לו לסרוק "אין סיליקו", כלומר באמצעות הדמיית מחשב, ספריות עצומות של מולקולות. המקבילה הניסויית לשיטה זו, המבוססת על מיכון רובוטי וספריות של תרכובות אמיתיות במעבדה, דורשת זמן, תשתיות ומשאבים אדירים, בעוד במחשב אפשר לסרוק מאות אלפי מולקולות בכל פעם. זאת ועוד: השיטה מאפשרת לבחון לא רק מולקולות קיימות, אלא גם כאלה שעדיין אינן קיימות.
במחקר שיתפו פעולה תלמיד המחקר עמית שרגא וחברים נוספים מקבוצת המחקר של ד"ר לונדון עם קבוצת המחקר של ד"ר זיו שולמן מהמחלקה לאימונולוגיה; עם ד"ר ברוס לפקר וד"ר צ'אקרפאני סובראמניאם, מדענים אורחים ממכון פייזר למחקר ופיתוח בארצות-הברית, ועם עמיתיהם במרכז הלאומי לרפואה מותאמת אישית על-שם ננסי וסטיבן גרנד בקמפוס המכון; עם פרופ' טקיושי מאוניברסיטת אוסקה, יפן, ועם ד"ר רוברט הודקינס מחברת "טבע".
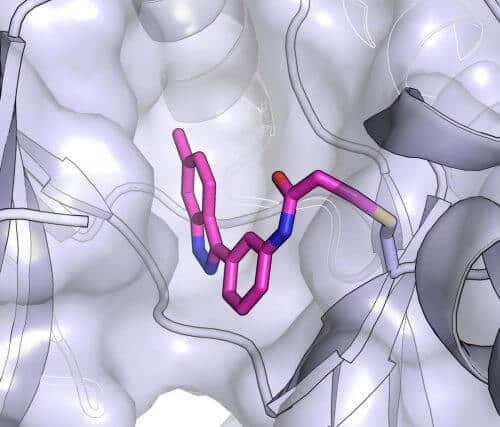
לאחר שזיהו כעשרה חומרים מבטיחים באמצעות סימולציות מחשב, פנו החוקרים לבחון אותם במעבדה. שלושה מהם פעלו היטב – אך רק אחד נקשר לקינאז ביעילות יוצאת דופן. באמצעות התוכנה יצר צוות המחקר "מודל קישור" כדי להבין כיצד בדיוק נקשר המעכב לחלבון. בהתאם למודל יצרו המדענים וריאציות שונות של המעכב כדי לבדוק אם אפשר להוסיף ולשפרו. לבסוף, בשיתוף המעבדה היפנית, יצרו החוקרים גביש של המולקולה יחד עם קינאז היעד שלה – מעין צילום של האינטראקציה, אך ברזולוציה אטומית. הם מצאו כי אתר הקשירה בפועל היה בדיוק כפי שחזה המודל.
המולקולה שזיהו ד"ר לונדון וחברי קבוצתו עשויה להיות בעלת יישומים רפואיים במניעת מוות בלתי-רצוי של תאים באלצהיימר, בהפחתת דלקות במחלות מעי דלקתיות ובסוכרת. "מכיוון שהמולקולה נקשרת קוולנטית לקינאז, היא מעכבת את החלבון במשך כל חייו. משמעות הדבר היא שאם המולקולה תוכיח עצמה בניסויים קליניים – שעדיין רחוקים מאוד – היא תוכל להינתן במינונים קטנים או לעתים רחוקות", אומר ד"ר לונדון. חברת "ידע", זרוע היישומים של המכון, הגישה בקשה לרישום פטנט על המולקולה.
