התערבות לפני הופעת התסמינים עשויה להיות המפתח לעצירת הגורם העיקרי לשיטיון או להאטתו
מאת גארי סטיקס
בספר מאה שנים של בדידות, יצירת המופת המאגית-ריאליסטית של הסופר הקולומביאני גבריאל גרסיה מרקס, לוקח הסופר את הקורא אל כפר הג'ונגל המיתי מקונדו, שם, באחת הסצנות המצוטטות ביותר, לוקים התושבים במחלה הגורמת להם לאבד את זיכרונם כליל. המחלה מוחקת את "שמם ומשמעותם של דברים ולבסוף זהותם של האנשים." התסמינים נמשכים עד שמגיע צועני נודד עם משקה "בעל צבע רך" המשיב להם את חייהם.
בעיר מדיין שבקולומביה, כעין מקבילה מציאותית של מקונדו, יקבלו אולי כמה מאות מתושבי העיר וסביבתה הזדמנות לסייע בחיפוש אחר גרסה ממשית של שיקוי הצועני. במדיין ובאזורי גידול הקפה שסביבה חיה הקבוצה הגדולה ביותר של אנשים הלוקים במחלת אלצהיימר תורשתית. נשים וגברים מ-25 משפחות מורחבות, המונות 5,000 בני משפחה, מפתחים מחלת אלצהיימר מוקדמת, בדרך כלל לפני גיל 50, אם הם נושאים גרסה פגומה של גן מסוים.
אלצהיימר מוקדם, העובר בתורשה כתכונה גנטית דומיננטית מהורה אחד בלבד, אחראי לפחות מאחוז אחד מ-27 מיליון מקרי האלצהיימר שתועדו בעולם ב-2006, אך נראה שהשינויים האופייניים במוח זהים לאלה של המחלה השכיחה יותר, שתסמיניה אינם מופיעים אלא אחרי גיל 65.
היכולת לצפות את הופעת המחלה במשפחות ממדיין משכה את תשומת לבם של מדענים וחברות תרופות, החוקרים את האפשרות לבדוק תרופות באמצעות הענקתן לחולים לפני שניכרים בהם סימני המחלה הראשונים.
בשנים האחרונות נכשלו כמה תרופות פוטנציאליות לטיפול במחלת אלצהיימר קלה עד בינונית, ולכן באו החוקרים לידי מסקנה שהפתולוגיה של המחלה – הצטברות של חלבונים פגומים ואובדן תאים או מעגלים במוח – מתחילה הרבה לפני שמתגלה הפגיעה בזיכרון. בעקבות הבנה זו, שאוששה על ידי טכנולוגיות חדשות המגלות את המחלה שנים לפני הופעת התסמין הראשון, הסכימו הכול שיש להתחיל את הטיפול עוד בשנים שבהן המחלה מתקדמת בלי סימנים חיצוניים כלשהם, כשהזיכרון של החולה עדיין תקין לחלוטין.
לפיכך נתח נכבד מחקר האלצהיימר מיועד כיום לעצירת המחלה לפני הופעת התסמינים – לא רק באמצעות תרופות, אלא גם באמצעות אורח חיים נכון, שיהיה בטוח וזול יותר מ-10 עד 20 שנה של צריכת תרופות.
התחלה מוקדמת
משפחות האלצהיימר הקולומביאניות הן חיל החלוץ של חקר המניעה. פרנסיסקו לופרה – נוירולוג שלפני 28 שנה נתקל בפעם הראשונה במשפחות אלו, שלימים התגלו כנשאיות של מוטציית פייסה (paisa הוא כינוים של בני האזור) – יצר קשר עם מאות מבני המשפחות שטרם חלו כדי לבדוק את נכונותם להשתתף בניסוי בתרופות שיסלקו או יעצרו את הצטברות פיסות החלבון הרעיל, פפטידים מסוג עמילואיד-בטא, הפוגעים בתאי מוח במהלך המחלה. "הידע שיתרמו משפחות אלה עשוי לזרות אור רב על הטיפול במחלת אלצהיימר ומניעתה בהופעתה המוקדמת והמאוחרת גם יחד," אומר לופרה.
במסגרת מאמץ נרחב הקרוי "היוזמה למניעת אלצהיימר" (API) אמור להתחיל ב-2011 ניסוי בבני המשפחות הנושאות את המוטציה: אנשים בריאים בסביבות גיל 40 יתחילו לקבל טיפול נוגד עמילואידים (תרופה או חיסון) שכבר הוכח כבטוח בקרב חולי אלצהיימר. הכוונה היא לשלוח לאזור ציקלוטרון – מאיץ חלקיקים קטן – שישמש כמה בתי חולים במדיין להכנת נותבים רדיואקטיביים לצורך בדיקות הדימות שיגלו אם התרופה מעכבת את הצטברות העמילואידים.
הניסוי יבחן אם מתן טיפול לנשאי הגן הפגום שבע שנים לפני הגיל הממוצע שבו מחלתם מאובחנת יכול לדחות או לעצור את המהלך השקט והנחרץ של המחלה. מלבד בחינה של טיפולים ספציפיים, מתכנני הניסוי בקולומביה רוצים לראות אם מעקב אחר סמנים ביולוגיים ספציפיים לאלצהיימר יאפשר לגלות אם הטיפול הניסיוני מועיל. (סמן ביולוגי הוא מחוון מדיד, כגון ריכוז של חלבון מסוים, המשתנה עם התקדמות המחלה או נסיגתה.) קבוצה אמינה של סמנים כאלה תאפשר לחוקרי התרופות ולרופאים המטפלים להעריך מהר למדי את הצלחת הטיפול, ולא יהיה צורך לחכות לתסמינים גלויים. ה-API מתכננת סדרה דומה של ניסויים בארצות הברית בקרב קבוצת נשאים של שני עותקים של גן מוטנטי, APOE4. גן זה מעלה את הסיכוי לאלצהיימר, אך אינו מנבא בוודאות שהמחלה אכן תפרוץ.
אם ה-API תצליח, היא תפרוץ את הדרך לניסויים רבים של מניעת אלצהיימר על בסיס סמנים ביולוגיים. להוכיח שתרופה מונעת מחלה אורך הרבה יותר זמן ועולה הרבה יותר כסף מלהראות שהיא מרפאת את מי שכבר חלה. "חברת תרופות לא תשקיע בניסוי מניעה ממושך של חומר לא מוכח שאולי יתגלה כלא יעיל," אומרת מריה קארייו, מנהלת קשרי מדע ורפואה באגודת האלצהיימר.
עם קבוצה של סמנים ביולוגיים ביד תוכל חברת תרופות לבדוק אם תרופה משנה את רמות העמילואידים או סמן ביולוגי אחר, כשם שרופאים בודקים רמות כולסטרול כמדד להשפעתו של סטטין במניעת מחלות לב. "עלינו לקדם טיפול לפני הופעת תסמינים. וָלא, אנו עלולים לאבד דור שלם," אומר אריק מ' ריימן, מנהל במכון באנר לאלצהיימר בפניקס, שיזם עם עמיתו פייר נ' טאריוט את ה-API.
ניסויים קליניים לבדיקת מניעה של מחלה מציבים קשיים רבים: קשה לשקול את תופעות הלוואי הבלתי נמנעות של התרופה מול התועלת הפוטנציאלית לאדם שעדיין אין לו תסמינים. יתרה מזו, איש אינו יכול לנבא אם תרופה שמועילה למחלת אלצהיימר מוקדמת תועיל גם לאנשים שאין להם המוטציה המסוימת הגורמת להופעה המוקדמת של המחלה. אבל הצורך הדחוף למצוא טיפולים חדשים – והפיתוי שבתרופה המכניסה מיליארדי דולרים – הניעו את פיתוחן של אסטרטגיות מניעה. בינואר 2010 התקיימה בארה"ב פגישה של ה-API, ובה נכחו 19 נציגים של חברות תרופות וביוטכנולוגיה מארה"ב ומאירופה. הדיון נסב על האפשרות ליצור ברית לא תחרותית בין האקדמיה לתעשייה, שמהותה שיתוף פעולה במחקרים קליניים והעברה חופשית של תוצאות ניסויים.
יש טיפולים לאלצהיימר, אבל אין בהם כדי להאט במידה ניכרת את התקדמות המחלה. טיפול שיעשה שינוי של ממש במחלה יזכה לביקוש אדיר. סטטיסטיקאים חוזים שעד אמצע המאה הנוכחית תעלה שכיחות האלצהיימר בעולם פי ארבעה ומספר החולים במחלה יגיע ל-107 מיליון. טיפול שיעכב את התפרצות המחלה, ולו בחמש שנים, יוריד למחצית את מספר המתים ממנה.
בתוך הראש שלך
עד לפני כחמש שנים היה ניסוי של מניעת אלצהיימר המבוסס על סמנים ביולוגיים מתקבל כפנטזיה מוחלטת. אבל בזכות שיטות דימות וטכנולוגיות אחרות כיום אפשר לעקוב אחר סמנים ביולוגיים ולחשוף את טבעו של תהליך המחלה. מאז 2004 פועלת בארה"ב "היוזמה לדימות עצבי של מחלת אלצהיימר" (ADNI), שבה משתפים פעולה חברות תרופות, אנשי אקדמיה והמכונים הלאומיים לבריאות (NIH). מה שהתחיל כפיתוח שיטות להערכה משופרת של יעילות התרופות בקרב נבדקים שכבר חלו במחלה, התרחב עד מהרה לבחינה של ההתרחשויות במהלך התקופה שלפני האבחון הממשי.
דיווח מסקרן אחד על התקדמות בתחום הגיע ב-21 בינואר 2010: קליפורד ר' ג'ק, ראש קבוצת ה-ADNI החוקרת סמנים ביולוגיים שאפשר לנטרם באמצעות דימות בתהודה מגנטית (MRI), תיאר מודל אפשרי של מהלך המחלה והצמיד אותו לסמנים ביולוגיים שנראה כי יש ביכולתם לעקוב אחר הפתולוגיה הזאת. ג'ק הציג את עבודתו, שגם הופיעה בכתב עת טכני, בסמינר מקוון ב- Alzforum לפני יותר מ-100 משתתפים, בהם רבים מן החוקרים המובילים בתחום. הסמינר, שאחת ממייסדיו היא ג'וּן קינושיטָה, עורכת לשעבר בסיינטיפיק אמריקן, הוא מקום מפגש להחלפת רעיונות, מאגר של מידע מחקרי ומקור לכתבות עומק על חקר האלצהיימר.
בסמינר המקוון ציין ג'ק שמדידות הסמנים הביולוגיים מרמזות שהתהליך מתחיל שנים לפני הופעת התסמינים שעל פיהם מאובחנת המחלה. בפרק זמן זה (המוערך בכ-5 עד 20 שנים) מתחיל להצטבר מחוץ לתאי מוח סוג מסוים של פפטיד עמילואידי, והוא פוגע בסינפסות, שהן נקודות המפגש בין תאי עצב. מולקולת נותב רדיואקטיבית, כגון PIB (Pittsburgh imaging compound-B), נקשרת לעמילואיד במוחו של הנבדק, ואז אפשר לגלות את מקום הימצאה בדימות באמצעות טומוגרפיית פליטת פוזיטרונים, PET. בשיטה זו התברר כי תהליך ההצטברות מואט לפני הופעת התסמינים המובהקים.
אחר כך, עדיין לפני האבחון, ניתקת משלדי התאים קבוצת חלבונים הקרויה טאו (tau), שבמצבה התקין מסייעת לתמיכה מבנית בתאי עצב. החלבונים מסתבכים, נעשים לגושים וזורעים הרס בתוך התאים. גושי הטאו מתגלים בבדיקת דגימה של נוזל שדרה. בדיקה זו יכולה לגלות גם ירידה ברמות עמילואיד-בטא, המתרחשת כשהפפטידים יוצאים מן הנוזל ויוצרים רבדים במוח. כשמוצאים ירידה ברמות העמילואיד-בטא ועלייה בטאו בנוזל השדרה פירוש הדבר, קרוב לוודאי, שתהליך המחלה כבר החל.
בין שנה לארבע שנים לפני אבחון המחלה מתחיל שלב הנקרא "פגיעה קוגניטיבית קלה". התסמינים המאפיינים את השלב הזה נעים בין אפיזודות של אובדן זיכרון לקבלת החלטות לקויה. פגיעה קוגניטיבית קלה עשויה לנבוע מסיבות אחרות, ולא מאלצהיימר דווקא. מכל מקום, חולים המתקדמים לקראת שיטיון אלצהיימר נפגעים פגיעה קוגניטיבית קלה כשתאי עצב באזורי מוח מסוימים ניזוקים או גוועים – והתהליך מואץ עם הזמן. (אם בעיות זיכרון הן התסמין הראשי, החולה מתקדם לקראת אלצהיימר בדרך כלל.) בשלב זה אפשר לקיים מעקב בשיטת דימות הקרויה MRI נפחי, שמודדת את שיעור ההתכווצות של המוח בשל מות תאי עצב. שרשרת האירועים, ובכלל זה הצטברות העמילואיד המוקדמת, משבשת את המטבוליזם של התא. הניטור בשלב זה אפשרי באמצעות בדיקת PET מיוחדת – fluorodeoxyglucose-PET (FDG-PET) – האומדת את המצב המטבולי של תאי עצב.
האם מצב החולה משתפר?
התבססותם של ניסויים קליניים לבדיקת מניעתה של המחלה על סמנים ביולוגיים מציבה אתגרים לא פשוטים הן לחברות התרופות והן למחוקק ומהווה מחסום לפריצה קדימה של ה-API ומאמצי מניעה אחרים. כדי שתרופה לאלצהיימר תאושר לשימוש יהיה צורך להראות שהתועלת הקוגניטיבית שהיא מביאה לחולה (בזיכרון, בשפה או במדד דומה) גדולה מזו של תרופת דמה (פלצבו).
אם במחקר מניעה עוקבים אחר סמן ביולוגי ולא אחר תסמינים, החוקרים צריכים להיות בטוחים שהמדידות אכן מראות על סיכויי הנבדק לפתח שיטיון. לדוגמה, החוקרים עדיין אינם יודעים אם שינוי רמות העמילואיד-בטא ימנע שיטיון בסופו של דבר, על אף גוף הראיות הגדול המראה כי עמילואיד-בטא תורם להתפתחות המחלה.
למעשה, בניסוי מוקדם של טיפול בעמילואיד ירדו רמות הפפטיד בכמה מן החולים, אך לא היה כמעט סימן לשיפור בקוגניציה. "אנו חוששים שאולי יש לנו תרופה המשפיעה על הסמן כפי שאנו צופים שתשפיע, אך איננה משפיעה על התמונה הקלינית של החולים," אומר ראסל כץ, מנהל היחידה למוצרי נוירולוגיה במנהל המזון והתרופות האמריקני. "במילים אחרות, המחלה שלהם ממשיכה להתפתח, ולא חל כל שיפור במצבם." כץ אומר שכדי לשלב סמנים ביולוגיים בניסויים קליניים מוטב להראות תחילה שהורדת הרמה של העמילואיד או של סמן ביולוגי אחר מועילה לאנשים הלוקים בפגיעה קוגניטיבית קלה או שאך זה אובחנו כחולי אלצהיימר, ורק אחרי כן לנסות להשתמש בסמנים ביולוגיים לטיפול באנשים ללא תסמינים. "הדרך הטובה ביותר להגיע למטרה, לדעתי, היא להתחיל עם חולים בעלי תסמינים, אולי חולים בשלבים מוקדמים מאוד, ואז לעבוד אחורה," אומר כץ.
אך החוקרים המבצעים את ניסויי המניעה בקולומביה אומרים בביטחון שהם כבר יכולים לגלות שינויים קלים בזיכרון באמצעות סמנים ביולוגיים, וכץ יכול להירגע. ריימן מצטט עבודה של קבוצתו שמציעה דרך נוספת להפיג את חששות המחוקק. במבדקים פסיכולוגיים שנעשו באותו מחקר הראו נשאי גרסת הגןAPOE4 ירידה קלה בדירוג הזיכרון שנים רבות לפני שהסתמן איזשהו חסך קוגניטיבי. רמה כזאת של רגישות, אומר ריימן, משמעה ששילוב של מבדק קוגניטיבי ומדידת סמן ביולוגי בניסוי מניעה עשוי להספיק כדי לרמוז אם ירידה ברמות העמילואיד אכן מעידה על סיכויים טובים יותר לא להגיע לשיטיון. לעת עתה כץ עדיין אינו משוכנע: "מהן הראיות לכך שהחולים האלה, על אף מצבם הקוגניטיבי הירוד, אכן ימשיכו ויפתחו מחלת אלצהיימר?" הוא אומר.
כמה חברות כבר חוקרות את השימוש בסמנים ביולוגיים. בריסטול-מאיירס סקוויב נוטלת דגימות מנוזל השדרה של חולים בעלי פגיעה קוגניטיבית קלה כדי לנסות ולחזות אילו מהם יפתחו אלצהיימר. מי שיימצאו אצלם רמה נמוכה של עמילואיד-בטא ורמה גבוהה של טאו יתאימו להשתתף בניסוי של תרופה החוסמת את האנזים גמא סקרטאז, המעורב בייצור של פפטיד העמילואיד-בטא. "אם אין לך הסמן הביולוגי המקושר לפתופיזיולוגיה של האלצהיימר, אינך מתאים להיות מטופל במחקר שלנו," אומר ולאד קוריק, מנהל רפואי במחלקת המחקר הקליני העולמי בבריסטול-מאיירס סקוויב. היכולת להתמקד רק בחולים בעלי סיכוי גבוה ללקות באלצהיימר תעזור להעריך אם התרופה אכן מועילה – הערכה שהייתה ברורה פחות אילו נכללו במחקר משתתפים בעלי סיכוי נמוך לחלות. "בעתיד אולי יתחילו המחקרים על תרופות מוקדם עוד יותר, בשלב הטרום-תסמיני," מוסיף קוריק.
בית מלאכה קוגניטיבי
משפחות האלצהיימר הקולומביאניות שבלב ה-API היו השראה גם לגישת מניעה חדשנית אחרת. חוקר המוח קנת ס' קוסיק, שעבד עם המשפחות הקולומביאניות כמעט 20 שנה וסייע לזהות את מוטציית הפייסה, הקים ב-2009 מרכז שהוא מכנה "בית מלאכה קוגניטיבי" בשכונת מגורים בסנטה ברברה שבקליפורניה. קוסיק הוא שארגן במדיין מפגש חשוב כדי להכניס את לופרה ואת המשפחות הקולומביאניות ל-API.
בית המלאכה הקוגניטיבי – ששמו הרשמי הוא המרכז לכושר ולטיפולים חדשניים קוגניטיביים (CFIT) – הוא חוף מבטחים הן למי שחווים בעיות זיכרון קלות שמתפתחות לעתים לאלצהיימר מלא והן לחוששים ללא סיבה ידועה. האנשים האלה מגיעים אל המבנה המסוגנן כדי לקבל, על סמך הראיות העדכניות ביותר, עצה בדבר שינויים שהם יכולים לעשות בחייהם כדי להדוף את צלו המאיים של השיטיון או להיטיב להתמודד אתו אם הוא מגיע.
קוסיק אימץ את רעיון ה-CFIT ממרכז אחר, Casa Neurociencias, מרפאת חוץ לא מהודרת שליד בית החולים המרכזי במדיין, שבה שהה שעות רבות בעבודה לצד לופרה. חולי אלצהיימר בעלי מוטציית פייסה, ועמם לא אחת עשרות בני משפחה, היו מגיעים מן הכפר בנסיעה ארוכה באוטובוס כדי לבלות במשך היום במרחב הפתוח של המרפאה, ובה הייתה לצוות הרפואי ולבני המשפחה גישה נוחה זה לזה. "מעניין ששם, במערכת הרפואית הלא מפותחת כל כך, הטיפול האישי ושירותי העזר היו זמינים יותר," אומר קוסיק.
קוסיק משווה את האווירה הטיפולית שם ליעילות הקלינית של בית הספר לרפואה של אוניברסיטת הרווארד, שם השתתף בהקמת מרפאה להפרעות זיכרון לפני שעבר לאוניברסיטת קליפורניה בסנטה ברברה ב-2004. "הייתי מתוסכל מכך שאנשים היו באים לקליניקה והיינו אומרים להם 'כן, זה נראה כמו אלצהיימר,' ואז שלום וזהו," הוא אומר. "היינו רואים אותם אחת לשישה חודשים, אבל לא יכולנו לעשות הרבה חוץ מלתעד את ההידרדרות שלהם."
CFIT משלב את האווירה הלא פורמלית של Casa Neurociencias עם המלצות לאורח חיים נכון, שרבות מהן מבוססות על גוף ידע מדעי מתפתח העולה ממחקרים חדשים, אפידמיולוגיים או בבעלי חיים, המרמזים כי פעילויות שונות עשויות לסייע לקוגניציה. אפידמיולוגים עוקבים אחר קבוצה נבחרת כדי לקבוע אם פעילות גופנית, תזונה או פעילויות רבות אחרות עשויות להקטין את הסיכוי לחלות במחלות כמו אלצהיימר, אף שנחוצים סוגי מחקרים מסודרים יותר כדי להסיק מסקנות החלטיות.
לאחר הערכה פיזית ופסיכולוגית מקבל הלקוח (לעולם אין משתמשים במילה "מטופל") סדרה של המלצות אישיות, בהן, למשל, לצרוך תזונה ים-תיכונית (שומנים בריאים וצריכה גבוהה של ירקות ופירות), להתעמל התעמלות אירובית ולשחק משחקי חשיבה מקוונים. במרכז מתקיימות כמה פעילויות שעדיין אינן מקובלות במקומות כמו מרפאת הזיכרון הקשורה להרווארד. במציאות החדשה, שבה חולים רוצים יותר שליטה בטיפול הרפואי שהם מקבלים, טוניה קיילנד, פסיכולוגית קוגניטיבית, עוזרת לאנשים להתמצא בסבך המידע הרפואי שבאינטרנט. היא מקרינה דפדפן אינטרנט על קיר חדר הישיבות המואפל, עוברת עם הלקוח, דף אחר דף, על ניסויים קליניים או מחקרים חדשים על כורכום או תוסף תזונה אחר שעשוי להגן על תאי מוח ומסבירה את משקל הראיות לגבי תרכובת אחת לעומת אחרת.
CFIT גם מתאם בדיקות להימצאות גרסת הגן APOE4. הבדיקה, המעוררת מחלוקת, מתבצעת לאחר ייעוץ ללקוח בדבר המשמעויות של ידיעת התוצאה: אם היא חיובית, ייתכן שגם אחים וצאצאים נושאים את הגן ומצויים בסיכון גבוה. קבוצות רפואיות רבות מתנגדות לבדיקה משום שידיעת המצב הגנטי אינה מאפשרת לקבוע באופן חד-משמעי אם האדם ילקה באלצהיימר, ומשום שאין בנמצא טיפולים מועילים באמת.
קוסיק, שהיה ממחבריו של אחד המאמרים הראשונים על חלבון טאו, מכחיש שהפך לרופא "ספא" שמקדם רעיונות מפוקפקים. המעבדה שלו באוניברסיטת קליפורניה בסנטה ברברה עדיין חוקרת את חלבון טאו ועוד ביולוגיה בסיסית אזוטרית. CFIT מתכוון למלא את החסר עד שה-API או יוזמה אחרת יוכלו לגלות תרופות או אמצעים אחרים שיעילותם תוכח. "הפתרונות שיש לנו כאן אינם הפתרונות הטובים ביותר," אומר קוסיק, "אבל אנחנו לא יודעים מתי תגיע התרופה שתטפל במחלה כפי שפניצילין מטפל בזיהום. אני חושב שזה חוסר אחריות לומר לאנשים שהדבר יקרה בתוך חמש או עשר שנים, כי אני לא חושב שאנחנו יודעים."
בשנים הבאות תיבחן גישת CFIT למניעה בניסויים קליניים קפדניים, במימון המדינה, שיגלו אם תזונה ופעילות גופנית אכן יכולות לדחות את המחלה, או אם הראיות האפידמיולוגיות היו סתם ברווז סטטיסטי. "אחת השאלות העיקריות בנוגע לאורח החיים," אומרת רייזה ספרלינג, פרופסורית לנוירולוגיה בבית הספר לרפואה של הרווארד, "היא אם התערבות משפיעה אחרת על אנשים שמוחם עדיין נורמלי ועל אנשים שבמוחם כבר ניכרים שינויי אלצהיימר. מקצת פעולות ההתערבות עשויות להוריד את הסיכון, אבל אם אתה כבר בדרך לשם – אם יש לך הגנים ואם הראש שלך כבר מלא עמילואידים – אולי הן לא יצליחו כל כך להאט את התקדמות המחלה, ולכן חשוב לבחון את הרעיונות האלה באמצעות סמנים ביולוגיים כדי לראות אם הם מועילים באמת."
בסופו של דבר, PET או דיקור מותני אולי יקבעו אם זיתים, גבינת עזים וחצי שעה יומית על מסילת ההליכה יסייעו לשמר את הקוגניציה, או שהם סתם עורבא פרח. אם יתברר שהסמנים הביולוגיים האלה שימושיים, עשויים המחקרים הביולוגיים וההתנהגותיים להתלכד למדע אמיתי של מניעת מחלת אלצהיימר.
___________________________________________________________
מושגי מפתח
שכיחות מחלת אלצהיימר ממשיכה לעלות עם הזדקנות האוכלוסייה, אך עדיין לא נמצאו טיפולים יעילים.
תרופות שכשלו עשויות להתגלות כיעילות אם יינתנו בשלב מוקדם יותר.
שיטות חדשות למעקב אחר המחלה לפני הופעת התסמינים יאפשרו לבדוק תרופות בשלב שבו אולי יהיו יעילות יותר.
אלצהיימר במספרים
השיטפון הצפוי
עם הזדקנות האוכלוסייה בארצות הברית ובעולם צפוי מספר חולי האלצהיימר החדשים לנסוק כי שכיחות המחלה עולה עם הגיל. על פי האומדן, כיום יש בארה"ב יותר מ-39 מיליון בני אדם מעל לגיל 65, ועד 2050 צפוי המספר להגיע ל-89 מיליון, יותר מפי שניים.
האוכלוסייה מזדקנת…
מיליוני בני אדם בני 65 ומעלה המתגוררים בארה"ב.
2050
כיום 2010
1900
…והגיל הוא גורם הסיכון העיקרי לאלצהיימר…
הסיכון של גברים ונשים לפתח אלצהיימר בגיל נתון בעשר השנים הקרובות.
… ולכן מספר חולי האלצהיימר גדל
מספר האנשים שיאובחנו כחולי אלצהיימר יעלה בכ-50% ב-20 השנים הבאות.
2000: 4.7 מיליון
2010: 5.3 מיליון
2030: 7.9 מיליון
100 שנות מחקר
1906: הפסיכיאטר הגרמני אלואיס אלצהיימר מתאר בראשונה (על סמך אוטופסיה של המוח) את רובדי החלבון ואת סבכי תאי העצב המאפיינים את המחלה.
50 השנים הבאות: אובדן זיכרון ותסמינים אחרים נחשבים לסניליות הנובעת מהזדקנות נורמלית.
1960-1970: מוכח קשר בין הידרדרות קוגניטיבית ובין מספר הרבדים וסבכי תאי העצב במוח.
1980-1990: חוקרים מתחילים לגלות את הביוכימיה הבסיסית של יצירת הרבדים והסבכים.
1990-2000: מתגלים גורמים גנטיים למחלה. התרופות הראשונות המשפרות את התסמינים יוצאות לשוק.
2000-2010: דימות ודיקור מותני מאפשרים למדענים לעקוב אחר מהלך המחלה. כמה תרופות לטיפול בתהליכי המחלה נכשלות בניסויים קליניים, ורבים מסיקים שצריך להתחיל לטפל בשלב מוקדם יותר.
התרופות כיום
קצת הקלה, אך אין די בה
כיום מטפלות התרופות בתסמינים קוגניטיביים בלבד ולא בתהליך המחלה המחולל אותם, והן פועלות לזמן מוגבל – בין כמה חודשים לכמה שנים.
סוג התרופה:
מעכבת אצטילכולינאסטראז (דוגמאות: sonepezil, galantamine)
מה היא עושה?
חוסמת את פעולת האנזים אצטילכולינאסטראז וכך מעלה את רמת האצטילכולין במוח. יתר אצטילכולין משפר את הקוגניציה, את מצב הרוח ואת ההתנהגות, וכך משתפר התפקוד היום-יומי.
סוג התרופה:
נוגדת קולטן NMDA
(תרופה אחת: memantine)
מה היא עושה?
מסייעת לשכך פעילות יתר באמצעות מולקולת איתות, גלוטמאט, שעשויה להביא לידי מות תאי עצב. התרופה אינה מפריעה להיווצרות נגעי התאים המקדמים את המחלה.
התקדמות לקראת מניעה
כלים חדשים מגלים סימנים מוקדמים סמויים
התהליך שבבסיס מחלת אלצהיימר מתחיל שנים לפני הופעת התסמינים המאפשרים אבחון. חוקרים יכולים כעת לעקוב אחריו בכלים המנטרים סמנים ביולוגיים הקשורים למחלת אלצהיימר, כגון דימות מוח ודיקור מותני: סימנים לשינויים ביולוגיים (כגון עלייה ברמות החלבונים הרעילים) המתרחשים תמיד במהלך המחלה. חוקרים מקווים שביום מן הימים יאפשרו בדיקות של סמנים ביולוגיים לגלות את המחלה בשלבים מוקדמים, והטיפול בשלבים אלה ימנע את השיטיון או יאט אותו.
הצטברות עמילואיד
5-20 שנים לפני האבחון של שיטיון אלצהיימר
בשלב מוקדם מצטברות פיסות חלבון הקרויות עמילואיד-בטא במרכזי המוח היוצרים זיכרונות חדשים. הצטברות העמילואיד, סמן ביולוגי המתגלה באמצעות נוכחות רבדים, גורמת נזק לסינפסות המקשרות בין תאי עצב (פרט). עמילואיד מונע מאותות כימיים (נוירוטרנסמיטרים) להגיע לקולטנים שעל תאי העצב המקבלים. את ההצטברות אפשר לראות בצורות שונות של דימות מוחי, כמו למשל טומוגרפיית פליטת פוזיטרונים (PET), המזהה תרכובת רדיואקטיבית – Pittsburgh imaging compound-B (PIB) – שנקשרת ספציפית לעמילואיד. גם דיקור מותני יכול לשמש לניטור של סמן העמילואיד.
הצטברות טאו
1-5 שנים לפני האבחון
לפני שהתסמינים מצדיקים אבחון אלצהיימר מתחילים חלבוני טאו בתוך תאי העצב לגלות התנהגות פרועה. במצב תקין טאו מסייע לתחזק את מבנה הצינוריות הזעירות (מיקרוטובולים), החיוני לתפקודם התקין של תאי העצב. אך כעת מתחילות קבוצות פוספט להצטבר על חלבוני טאו (פרט), ואלה ניתקים מן המיקרוטובולים. המיקרוטובולים מתפוררים וחלבוני הטאו מתלכדים ויוצרים גושים מפותלים המשבשים את תפקוד התא. אפשר לגלות את התהליך בדגימת נוזל שדרה.
התכווצות המוח
1-3 שנים לפני האבחון
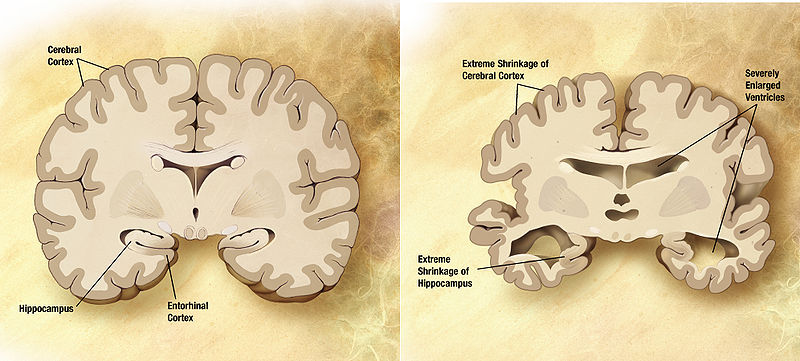
עם התקדמות תהליך המחלה תאי עצב מתחילים למות, והחולים ובני משפחותיהם מרגישים פגיעה בזיכרון ובתפקודים קוגניטיביים אחרים. מות התאים מכווץ את המוח באזורים הקשורים לזיכרון (בהיפוקמפוס) ולתפקודי מוח גבוהים (קליפת המוח), ואפשר לעקוב אחר הדבר בסוג של דימות תהודה מגנטית המודד את נפח המוח. ההתנוונות מואצת ומגיעה לבסוף לאזורים רבים של המוח.
מצב הטיפול
מדוע הטיפולים אינם מועילים
כל תרופה שתעכב או תעצור אלצהיימר במידה ניכרת תהיה להיט מידי, ומכירותיה אולי יעלו על אלה של פרוזק או ליפיטור. אין תרופות כאלה בשוק כי החוקרים עדיין מנסים להבין כיצד לשנות את המנגנון שבאמצעותו המחלה גורמת לשיטיון.
דוגמה לכך הן התרופות המעכבות בנייה של רובדי עמילואיד: כמה מועמדים לתרופה, המצויים בשלבי ניסוי שונים, מסוגלים לכאורה לעכב את הצטברות העמילואיד או לזרז את סילוקו. עם זאת, כמה תרופות עמילואיד שנבחנו בניסויים קליניים כבר נכשלו. יש חוקרים התמהים אם עד כה לא נתנו את הדעת במידה הראויה להפרעה לתהליכים אחרים התורמים למחלה. בין כ-100 החומרים השונים המצויים כיום בפיתוח יש כמה מועמדים לתרופות הפועלים נגד חלבוני טאו הפוגעים בתאי העצב. כמה מהם מיועדים לשכך דלקות, להאיץ את פעולת המיטוכונדריה, להעלות את רמת האינסולין במוח או להגן על תאי העצב בדרכים אחרות. הכישלון הגדול האחרון היה Dimebon, חומר שדווקא לא פעל נגד עמילואידים. ייתכן שיהיה צורך לשלב כמה חומרים כדי להאט או לעצור אלצהיימר, כמו שנעשה בפיתוח תרופות נגד סרטן ואיידס.
תרופות במחקר
מה הן עושות
מעכבי אנזימים מייצרי עמילואיד-בטא
אנזימים מסוימים חותכים חלבונים גדולים ומשחררים קטעי עמילואיד-בטא. המעכבים חוסמים את האנזימים האלה או משנים את אופן פעולתם.
תרכיבי חיסון או נוגדנים המנקים רבדים של עמילואיד-בטא
התרכיבים מפעילים את הגוף כדי לייצר נוגדנים הנקשרים לעמילואידים ומסלקים אותם מן המוח. למרבה הצער, גם התרכיבים וגם הנוגדנים גרמו בניסויים הקליניים לתופעות לוואי בדרגות חריפות שונות אצל כמה מן הנבדקים.
חוסמי התקבצות עמילואיד-בטא
חומרים שימנעו משברי עמילואיד להתקבץ ביחד עשויים למנוע נזק לתאי העצב.
חומרי אנטי-טאו
אף על פי שמספרם של חומרים אלה קטן ממספרם של אלה המכוונים נגד מסלול העמילואיד, הם פועלים בכמה גישות, כמו חסימת ייצור הצורה הרעילה של חלבון טאו ובלימת ההסתבכות שלו לקשרים.
חומרים פרו-אקטיביים עצביים
כמה גישות שונות מנסות להמריץ את ייצור הכימיקלים הטבעיים של המוח המשפרים את בריאות העצבים. באחד התכשירים מכניסים למוח גן שמתחיל את ייצורו של חומר מגן.
יבוא מקולומביה
הנוירולוג פרנסיסקו לופרה בנה תקן לטיפול בקבוצת המשפחות הגדולה הלוקה בצורה תורשתית של אלצהיימר במרפאה במדיין שבקולומביה. גישת הטיפול הזאת, הממוקדת בקהילה, שייסדו לופרה ועמיתיו, שימשה השראה ל"בית המלאכה הקוגניטיבי" בסנטה ברברה, שבו הלקוחות מעורבים בתכניות של תרגול גופני ופעילויות אחרות שמיועדות להקטין את הסיכון לשיטיון.
ועוד בנושא
The Alzheimer’s Project: Momentum in Science. Based on the HBO documentary. John Hoffman and Susan Froemke, with Susan K. Golant. Public Affairs Books, New York, 2009.
The Alzheimer’s Solution: How Today’s Care Is Failing Millions and How We Can Do Better. Kenneth S. Kosik and Ellen Clegg. Prometheus Books, 2010.
דיון עם כמה חוקרים מובילים שהנחה גבריאל סטרובל ב-21 בינואר 2010 על סמנים ביולוגיים למעקב אחרי מחלה

5 תגובות
קראו דברים קצת יותר מלומדים על שמן קוקוס כאן:
http://scienceblogs.com/insolence/2011/01/dr_oz_finally_unequivocally_embraces_the.php
בכלל – כל סיפורי ההסתרה הללו פשוט הזויים.
בעתיד יתפרסם כאן מאמר של שרמר על סיפורי קונספירציות.
זה אולי נשמע הזוי למי שלא שמע זה על קודם אבל 2 כפות שמן קוקוס ביום לחולה עוצרים את התפשטות המחלה. תעשו גוגל על "שמן קוקוס ואלצהיימר". למי שמטפל בחולה אלצהיימר וכמובן שלחולה עצמו אין פה מה להפסיד. חברות התרופות לא רוצות שהמידע הזה יגיע לציבור הרחב כי מדובר בהרבה הרבה כסף שהם יפסידו אם יפסיקו לקנות את התרופות שלהם. בקיצור, 2 כפות שמן קוקוס ליום.זה פשוט, זול זמין והכי חשוב זה עוזר.
זה אולי נשמע הזוי למי שלא שמע על קודם אבל 2 כפות שמן קוקוס ביום לחולה עוצרים את התפשטות המחלה. תעשו גוגל על "שמן קוקוס ואלצהיימר". למי שמטפל בחולה אלצהיימר וכמובן שלחולה עצמו אין פה מה להפסיד. חברות התרופות לא רוצות שהמידע הזה יגיע לציבור הרחב כי מדובר בהרבה הרבה כסף שהם יפסידו אם יפסיקו לקנות את התרופות שלהם. בקיצור, 2 כפות שמן קוקוס ליום.זה פשוט, זול זמין והכי חשוב זה עוזר.
נמאס כבר מהמנטרה הזאת של הקונספירציה.
יריב: מה אתה עושה בעניין חוץ מלבוא בטענות אל אחרים?
כמה כסף הם הולכים לעשות…עוד עשרות שנים של אנשים ללא תסמינים שמקבלים תרופות.
לא שאני אומר שלא להשתמש אבל במקום לנסות ולמצוא פתרון שבאמת יפתור את הבעיה נראה שהמאמצים נלקחים לכיוון של לשעבד אנשים לתרופות שלהם..