בכוונתם להמשיך במחקר ולפתח טיפולים חדשניים שינטרלו חיידקים אלימים העמידים לאנטיביוטיקה
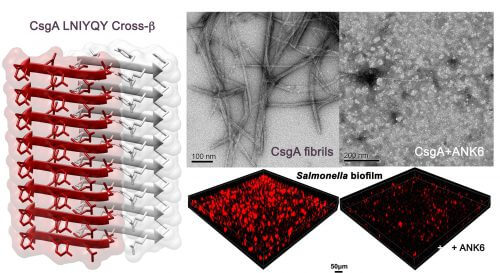
פרופ'-חבר מיטל לנדאו והדוקטורנט ניר סלינס מהפקולטה לביולוגיה בטכניון הצליחו לפגוע ביצירה של ביופילם של חיידקי סלמונלה. ביופילם הוא קרום עמיד המהווה בעיה רפואית וסביבתית חמורה משום שהוא מגן על החיידקים ומאפשר להם להיצמד לרקמות, לצינורות, למשטחים, למכשור רפואי ועוד. תגליתם של החוקרים צפויה להוביל לפיתוח טיפולים חדשניים שיעכבו עמידות לאנטיביוטיקה בקרב חיידקים אלימים.
בשנת 2017 פרסם צוות המחקר של פרופ"ח לנדאו, בכתב העת Science, גילויים חדשים על הסטפילוקוק הזהוב – חיידק אלים במיוחד שפיתח עמידות לזנים רבים של אנטיביוטיקה ואחראי לחלק ניכר ממקרי ההדבקה המתרחשים בבתי חולים ובקהילה. החוקרים גילו כי חיידק זה, התוקף את תאיו של האורגניזם ואת מערכת החיסון שלו, עושה זאת בין השאר באמצעות סיבים ייחודיים שהוא מפריש. סיבים רעילים אלה מזכירים עמילואידים, חלבונים הקשורים למחלות נוירודגנרטיביות כגון אלצהיימר ופרקינסון, אך שונים מהם מבחינה מבנית. במאמר שהתפרסם ב-2018 בכתב העת Nature Communication גילו סלינס ועמיתיו בצוות המחקר כי חלבונים מאותה משפחה של הסיב הרעיל יוצרים מבנים עמילואידים יציבים מאוד, המחזיקים מעמד בתנאים קשים מאוד ומגינים על החיידק. פרופ' לנדאו הביעה תקווה שגילויים אלו יובילו לטיפולים חדשים שיפגעו בסיבים ויפחיתו משמעותית את האגרסיביות של זיהומים קשים שגורם הסטפילוקוק הזהוב.
כעת, במחקר המתפרסם בכתב העת PLoS Pathogens, גילו חוקרי הטכניון כי פגיעה בסיבים העמילואידים שיוצרים חיידקי אי-קולי וסלמונלה, המעורבים בזיהומי מזון, פוגעת במנגנוני ההגנה של החיידקים וביכולתם להיצמד לרקמות ולמכשור רפואי. זאת באמצעות ייעוד-מחדש (Repurposing) של חומרים שכבר עברו ניסויים קליניים לטיפול באלצהיימר. יתרונו הגדול של ייעוד-מחדש בכך שתהליך האישור קצר וזול הרבה יותר מזה של תרופה חדשה.
החומרים שנבדקו על חיידק הסלמונלה אינם פוגעים בחיידק באופן ישיר; הם פוגעים בביופילם, שהוא כאמור קרום עמיד המגן על החיידקים מפני חומרים המסכנים אותם, לרבות תרופות אנטיביוטיות. החוקרים מעריכים שהפגיעה בביופילם לא תוביל להתפתחות עמידות כיוון שהיא אינה מאלצת את החיידקים להגן על חייהם. זאת בניגוד לתרופות אנטיביוטיות, שהשימוש בהן גורם להגברת עמידותו של החיידק ואלימותו.
המחקר אמנם התמקד בחיידקי סלמונלה ואי-קולי, הקשורים בזיהומי מזון, אבל החוקרים מקווים כי הוא יועיל גם במאבק בחיידקים אחרים ובהם הסטפילוקוק הזהוב. בהמשך מחקר הדוקטורט שלו יתמקד סלינס בפיתוח חומרים אנטיבקטריאליים יציבים ובסריקת מולקולות קטנות שיעכבו את יצירת הסיבים העמילואידיים בחיידקים. הוא מקווה כי פיתוחים כאלה יאיצו את המאבק החיוני בהתפתחות זנים אלימים של חיידקים העמידים לאנטיביוטיקה.

במחקר שותפים חוקרים מהמכון למערכות מורכבות ביוליך ובדיסלדורף, גרמניה. בטכניון סייעו בעבודה זו המרכז לביולוגיה מבנית, המרכז למדעי החיים וההנדסה ע"ש לורי לוקיי, המרכז למיקרוסקופיית אלקטרונים (מיק”א) והמרכז למיקרוסקופיית אלקטרונים של חומר רך במכון ראסל ברי לננוטכנולוגיה.
פרופ'-חבר מיטל לנדאו הצטרפה לסגל הטכניון אחרי פוסט-דוקטורט באוניברסיטת קליפורניה לוס אנג'לס (UCLA), שם התמחתה במיקרו-קריסטלוגרפיה בקרני X ובעמילואידים הקשורים במחלת אלצהיימר. בספטמבר 2012 היא הקימה בטכניון את המעבדה שלה בפקולטה לביולוגיה.
ניר סלינס השלים בטכניון תואר ראשון בביוכימיה מולקולרית בפקולטה לכימיה ע"ש שוליך וכיום הוא נמצא במסלול ישיר לדוקטורט בפקולטה לביולוגיה.
עוד בנושא באתר הידען:
