נוגד-הדיכאון הידוע פרוזאק (או בשמו הכימי פלוקסטין) מתפקד ככימוסנסיטייזר יעיל ביותר, ובמינון נמוך מאוד במלחמה נגד גידולים סרטניים עמידים.
פרופ' רמונה מרגלית והדוקטורנט דן פאר, מהמחלקה לביוכימיה בפקולטה למדעי החיים של אוניברסיטת תל אביב, גלו לאחרונה כי נוגד-הדיכאון הידוע פרוזאק (או בשמו הכימי פלוקסטין) מתפקד ככימוסנסיטייזר יעיל ביותר, ובמינון נמוך מאוד במלחמה נגד גידולים סרטניים עמידים.. מינון הקטן משמעותית מן התחום הבטוח והמותר בטיפול בדכאון, וחופשי מתופעות לואי קשות ומסכנות רעילות.
ממצאי המחקר, המתפרסמים לראשונה היום , בגליון ה 15 באוקטובר של כתב העת Cancer Research, הושגו בתרביות תאים סרטניים שמקורם מיונקים, ובמודלים של סרטן בעכברים כולל סרטן ממקור הומני.
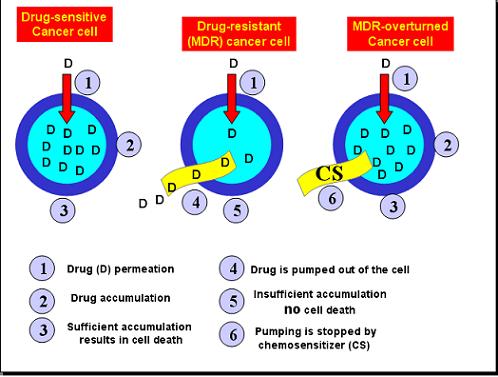
טיפול באמצעות תרופות כימותירפיות, בלבדן או בשילוב עם תהליך כירורגי, הינו אחת הדרכים המרכזיות למלחמה בסרטן. אולם למרות ההתקדמות העניפה באמצעי הטיפול ובשיטות לגילוי מוקדם, עדיין רב מדי מספר החולים עבורם הקרב במחלה נכשל. אחד הגורמים המרכזיים לכשלון הטיפול התרופתי נובע מעמידות מרבית הגידולים (כ 80% מן המקרים) למגוון רחב של תרופות נוגדות-סרטן, עמידות המכונה לכן רב-תרופתית ((Multidrug resistance, MDR. במנגנון זה לא חל שום שינוי בתרופה עצמה, אלא המדובר בליקויי אספקה. הן בסרטנים רגישים לתרופות והן בסרטנים העמידים על התרופה לחדור לתוך התא על מנת לבצע את פעולת ההרג שלה. ההבדל בין רגישות לעמידות הינו שבמקרים הרגישים התרופה מצטברת בתוך התא עד לרמה מספיקה להרג, ואילו בתאים העמידים התרופה שהצליחה לחדור לתוך התא איננה מצטברת בו. בממברנות התאים העמידים ישנן משאבות, חלקן מולדות וחלקן נרכשות, השואבות את התרופה אל מחוץ לתא בקצב ובעוצמה גדולים משמעותית מקצב כניסתה לתא. כתוצאה מכך רמת התרופה בתא העמיד נמוכה מאוד ורחוקה מסף ההרג. המשאבות אינן ברירניות ולפיכף לא רק שהן שואבות מגוון רב של התרופות הותיקות, אלא קיימת סכנה מוחשית שהן תעשינה כך – ולפיכך תחבלנה בטיפול – גם עם תרופות חדשות ועתידיות.
הדרך להתגבר על העמידות הרב-תרופתית היא ישירה ופשוטה-לכאורה: להפסיק את השאיבה ולאפשר בכך לכמות מספיקה של תרופה להצטבר בתא העמיד, כמו בתא הרגיש. תהליך זה מכונה כימוסנסיטיזציה ומגיבים המסוגלים לבצע הליך זה מכונים כימוסנסיטייזרים.
במציאות התגלה כי הדרך הפשוטה-לכאורה איננה פשוטה כלל וכלל, ולא מהעדר כימוסנסיטייזרים אלא מהעדר כימוסנסיטייזרים שניתן לטפל בהם בביטחה בחולים. תרופות שכבר היו מאושרות לטיפולים אחרים (שאינם סרטניים) וגילו יכולת להפסקת השאיבה נמצאו היו הדור הראשון של כימוסנסיטייזרים אולם למרבה הצער לא ניתן לטפל באמצעותם בחולי הסרטן. זאת מפני שתחום המינון שנדרש מתרופות אילו על מנת להתגבר על העמידות הרב-תרופתית גבוה בהרבה מן המותר וחורג אל התחום בו נגרמות תופעות לואי קשות ורעילות. תולדות כימיות של הדור הראשון לא הביאו לשינוי במצב ומעטות בלבד מן המולקולות חדשות שסונתזו על בסיס קומבינטוריקה כימית הגיעו לשלבים הראשונים של ניסויים קליניים.
כך, לאחר שלושה עשורים של הכרה התופעה והבנתה, ושלושה דורות של כימוסנסיטייזירים, העמידות הרב-תרופתית הינה עדיין בעיה קלינית כיבדת משקל ללא פתרון ישים.
לצד הממצאים שגלו החוקרים באשר לפרוזק נדרשת זהירות מירבית שכן השימוש בפרוזק להתגברות על העמידות הרב-תרופתית עדיין לא נבחן בבני אדם. בחינה זו נדרשת לא רק לשם אישוש הממצאים, אלא גם על מנת לפתח פרוטוקול טיפול מדויק ולתחום את טווח המינונים שיהיה יעיל מבלי לגרום נזקים. אם תוצאות המחקרים יאוששו בבני אדם, תהיה בכך פריצת דרך שתוביל להתקדמות ממשית בקרב כנגד הסרטן, באמצעות תרופות ותיקות המאושרות לשימוש.
על החוקרים:
פרופ' רמונה מרגלית
פרופ' רמונה מרגלית היא בוגרת ומוסמכת האוניברסיטה העברית בכימיה, ובעלת תואר דוקטור מאוניברסיטת תל אביב בביוכימיה וביופיסיקה. את לימודי הבתר-דוקטורט עשתה בתחום הביופיסיקה של ממברנות באוניברסיטה של קליפורניה בלוס אנג'לס. פרופ' מרגלית הינה חברת סגל המחלקה לביוכימיה, בפקולטה למדעי החיים באוניברסיטת תל אביב, וכיהנה כראש המחלקה בשנים 2003-1999. לפרופ' מרגלית בוגרים רבים שעשו את לימודיהם לתואר השני והשלישי בהנחייתה, והותיקים שבהם כבר תופסים עמדות בכירות בישראל באקדמיה, בתעשיות התרופות והביוטכנולוגיה ובמעבדות מחקר רפואיות. תחומי ההתענינות של פרופ' מרגלית הינם ננו-ביוטכנולגיה, נשאי תרופות ותהליכי טרנספורט בממברנות ביולוגיות המחוללים בעיות פתולוגיות. במהלך השנים פרופ' מרגלית המציאה ופיתחה שתי טכנולוגיות – חלקן כבר מעוגנות בפטנטים בינלאומיים וחלקם בהליכים לרישום פטנטים – לשגור תרופות באמצעות ננו-חלקיקים בעלי יכולת הכוונה למטרה (Targeting), האחת מהן בשיתוף פעולה עם הדוקטורנט דן פאר. יחד עם קולגות ממוסדות אחרים בארץ פרופ' מרגלית הקימה את האגודה הישראלית לשחרור מבוקר של ביו-חומרים שהינה סניף של האגודה המדעית הבינלאומית לשחרור מבוקר, ויש לה קשרי מחקר עם תעשיות רפואיות וביוטכנולוגיות בישראל ובעולם. במחקריה בתחום תהליכי טרנספורט פתולוגיים מתמקדת פרופ' מרגלית במערכות השואבות תרופות כימותירפיות מתוך תאים סרטניים, וגורמות בכך לעמידות הגידולים הסרטניים כנגד תרופות אילו, עמידות שהינה בעיה קלינית כיבדת משקל. מאמצי המחקר כוונו במיוחד למציאת ופיתוח אמצעים למניעת השאיבה, שאפשר יהיה לטפל בהם בחולי סרטן כך שיביאו פתרון הולם לבעיה ויחד עם זאת לא יגרמו נזק למטופל. במסגרת מחקרים אילו, מצאו פרופ' מרגלות והדוקטורנט דן פאר את הפעילות הנוספת של נוגד-הדיכאון פרוזק למניעת שאיבת תרופות כימותירפיות מתוך התא הסרטני.
דן פאר
דן קיבל את כל הכשרתו האקדמית באוניברסיטת ת"א, בפקולטה למדעי החיים ואת המחקרים לתואר השני והשלישי עשה בהנחייתה של פרופ' רמונה מרגלית, במחלקה לביוכימיה. ההתמחות שלו היא בתחום הביופיסיקה והביוכימיה, במיוחד לכוון הביו-רפואי תוך התמקדות על תחום הסרטן. המחקרים שלו במהלך הדוקטורט עסקו בפיתוח ואפיון נשאי תרופות שהם ננו-חלקיקים בעלי יכולת הכוונת מדוייקת לגידול הסרטני. במהלך מחקרים אילו דן נחשף לעמידות גידולים ממאירים לתרופות הכימותירפיות, וגילה יחד עם פרופ' מרגלית את הפעילות הנוספת של התרופה נוגדת-הדיכאון, פרוזאק, להתגברות על עמידות זו. במהלך לימודיו לדוקטורט דן זכה למלגות הצטיינות, לפרס וולף לדוקטורנטים, למלגות בינלאומיות להשתתפות בכנסים, והוזמן לתת הרצאות בכנסים ובמוסדות מחקר בינלאומיים. דן ממציא שותף (עם פרופ' רמונה מרגלית) במספר המצאות שהוגשו לרישום פטנטים (מהם אחד כבר אושר) שרשמה אוניברסיטת ת"א באמצעות החברה הכלכלית שלה.
