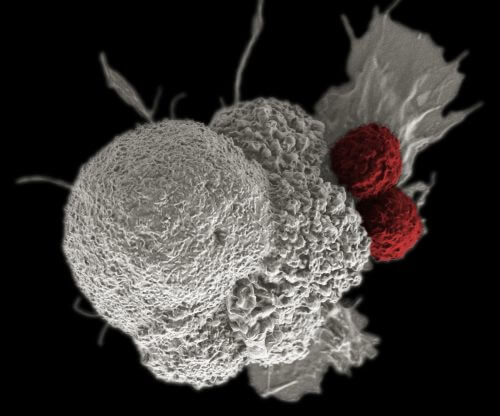
חיזוק מערכת החיסון של הגוף מביא לתוצאות מבטיחות במאבק במחלות ממאירות
בקיצור
- דור חדש של טיפולים שמגבירים את יכולתה של מערכת החיסון להילחם ולשלוט בתאים ממאירים לאורך זמן, השיג תוצאות מרשימות במרוצת חמש השנים האחרונות.
- אלפי אנשים עם סרטן ריאות או סרטן עור אלימים ומתקדמים, וכן עם סוגים שונים של לויקמיה ולימפומה, טופלו, ורבים מהם ככל הנראה נרפאו.
- חוקרים מפתחים כעת מערכי טיפול חדשים ושילובי תרופות שעשויים להיות בטוחים יותר ויעילים יותר לעומת הגישות המשמשות כיום.
ב-2013 אובחנה מישל בויאר כחולָה בסרטן עור מפושט ואלים. לו הייתה מקבלת את האבחנה הזאת שלוש שנים קודם לכן, ב-2010, כנראה שהיום היא הייתה כבר מתה. המלנומה, סרטן העור הקטלני ביותר, התפשטה לריאותיה מִשוּמה על גבה, והיא ידעה שהתחזית שלה עגומה. אבל החל ממאי 2013, תושבת סיאטל בת ה-29 החלה לקבל סדרה של טיפולים מהפכניים, שחלקם היו זמינים לראשונה רק ב-2011, שגרמו למערכת החיסון שלה לזהות, לתקוף ולכווץ את הגידולים. אף שבויאר עדיין חולָה בסרטן, ועל אף תופעות הלוואי של התרופות המעודדות את מערכת החיסון שלה, היא שמחה שהיא בחיים, ומקווה שהטיפול הנוכחי או הבא יספקו לה בסופו של דבר את התוצאה הפלאית שעליה מדברים באינטרנט חולים אחרים. "כרגע, אלו הם חיי," היא אומרת. "אנשים חושבים שמאוד קשה לשמור על גישה חיובית, אבל מכיוון שלי זה נראה טבעי, זה לא כזה מאמץ כפי שהיה אפשר לחשוב."
קארן קוהלר, בת 59, מורה לשעבר לחינוך מיוחד מפארק רידג' שבניו ג'רזי, זכתה כנראה בכל הקופה כבר בניסיון הראשון שלה. היא ככל הנראה נרפאה מסוג אחר של סרטן, במקרה שלה מלויקמיה, לאחר עירוי יחיד, בתחילת 2015, של תאים ממערכת החיסון שלה עצמה, שהונדסו בהנדסה גנטית כדי להילחם בסרטן בעוצמה רבה. הטיפול, שארך כמה שעות, הוביל אותה לטיפול נמרץ לכמה ימים, כי מערכת החיסון המתודלקת שלה נכנסה לפעילות־יתר גדולה מאוד. לאחר מכן היא אושפזה לכמה שבועות. אבל חודש לאחר הטיפול, לא נמצא בסריקות שום סימן לסרטן בגופה.
בויאר וקוהלר הן שתיים מאלפי חולי סרטן שעברו סוגים שונים של אימוּנוֹתֶרַפְּיָה – טיפול באמצעות מערכת החיסון של החולה – במהלך חמש השנים האחרונות. החוויות שלהן מדגימות הן את הפוטנציאל והן את האתגרים של גישה חדשה זו לטיפול בסרטן, גישה שאינה מציפה את הגוף בכימיקלים רעילים או בקרינה חיצונית כדי להשמיד תאים סרטניים, אלא ממריצה את המערך הפנימי המורכב של התאים והאותות המולקולריים של רשתות ההגנה של הגוף. התוצאות עד כה מעודדות. אימוּנוֹתֶרַפְּיָה נעשית במהירות לעמוד תווך, לצדם של ניתוחים, הקרנות וכימותרפיה, בטיפול בסוגי סרטן מסוימים.
בניסויים קליניים של שיטות אימוּנוֹתֶרַפְּיָה חדשות שנועדו להילחם בצורה אלימה במיוחד של לויקמיה, חוו 90% מן החולים נסיגה מלאה: רופאים לא מצאו כל עדות להישנות מחלתם בשום מקום בגוף. אף שאצל חלקם הסרטן אולי יתפרץ שוב, אצל רבים אחרים התגובה מסמנת כנראה ריפוי מלא. בניסויים אחרים, יותר ממחצית החולים במלנומה מתקדמת שקיבלו אימוּנוֹתֶרַפְּיָה יכולים כעת להעריך את תוחלת החיים שלהם בשנים במקום בחודשים. אימוּנוֹתֶרַפְּיָה, אומר גרי גילילנד נשיא ומנכ"ל מרכז פרד הצ'ינסון לחקר סרטן בסיאטל, "היא באמת פרדגימה שמשנה את הגישה שלנו לטיפול בסרטן."
ואולם, יש להודות שמדובר בתחילת הדרך. הארכת תוחלת החיים בכמה שנים לגבי כמה סוגי סרטן פירושה שחולים עדיין מתים מן המחלה. כך שמדענים ממשיכים לחקור דרכים חדשות להמריץ את התגובה החיסונית, ובכללן חיסונים, נגיפים, תאים מהונדסים גנטית וכדורים [ראו איורים]. הם גם מתחילים לשלב גישות שונות כדי לראות אם אפשר לעזור ליותר חולים, ואולי עם פחות תופעות לוואי. אבל כבר אין ספק שרופאים יכולים להשפיע על מערכת החיסון כדי לנצח את הסרטן, לפחות בחלק מן המקרים. "[אנחנו] בסופה של ההתחלה" של סיפור האימוּנוֹתֶרַפְּיָה, אומר אריק רובין, סמנכ"ל אונקולוגיה קלינית גלובלית של מעבדות המחקר של חברת מֶרְק.
הצלחה נוזלית
השאיפה להילחם בסרטן בעזרת מערכת החיסון החלה לפני לפחות 125 שנה אצל ויליאם קולי מניו יורק, רופא שהזריק למקצת חולי הסרטן שלו חיידקים, בניסיון לעורר את תהליכי הריפוי הטבעיים של הגוף. הגישה של קולי נוסתה תחילה בידי כמה רופאים אחרים. אבל היא ירדה מגדולתה לאחר מותו ב-1936, והוחלפה בכימותרפיה, ולאחר מכן בטיפולים הורמונליים או בעזרת נוגדנים, שהביאו לתוצאות עקביות יותר בשיעור גבוה יותר של חולים.
אבל הרעיון להמריץ את מערכת החיסון מעולם לא חדל לעורר עניין, והוא קודם באופן חלקי בידי המכון לחקר הסרטן, עמותה בניו יורק שהקימה ב-1953 בתו של קולי. בעשרות השנים האחרונות עזרה הביולוגיה המולקולרית לחוקרים להטיב ולהבין את מערכת החיסון, את האופן שבו היא פועלת ומתי היא כושלת. חוקרי הסרטן קיבלו כעת כלי נשק אימונולוגיים חזקים יותר.
בין המטרות המפתות ביותר לכלי נשק אלו נמנים סוגי הסרטן הפוגעים במערכות הדם והלימפה, כמו לויקמיה ולימפומה. מחלות אלו מתרחשות כשסוגים שונים של תאי־אב הקרויים תאי גזע, שלרוב מייצרים את התאים האדומים והלבנים בדם (ורקמות אחרות), צוברים מוטציות, גדלים ללא בקרה, דוחקים תאים בריאים ופוגעים בתפקודים חיוניים של הגוף. רבים מן הגידולים האלה, הקרויים גידולים נוזליים, נוצרים כשמשהו משתבש בתאים של מערכת החיסון הקרויים תאי B. באופן תקין, תאי B מייצרים נוגדנים כנגד חיידקים ונגיפים. (תאי B גם עוזרים לתאם תגובות חיסוניות אחרות, עם תאים נוספים הקרויים תאי T.) אבל כשתאי B הופכים לתאים סרטניים, הם הורסים את הגוף מבפנים.
בשלהי המאה ה-20, פיתחו חוקרים את המקבילה הביולוגית של טיל מונחה, שנקשר לחלבון (CD20) המצוי על פני השטח של תאי B בשלב מסוים ומאוחר של קיומם. הנוגדן החד־שבטי הזה, הקרוי ריטוקסימַאבּ, מאותת לתאי T לעשות משהו שהם לרוב נמנעים ממנו: לתקוף ולהרוג תאי B זקנים, המבטאים את CD20.
הבעיה הייתה ש-CD20 אינו סמן ספציפי לתאי סרטן. הוא מופיע הן על תאי B תקינים והן על התאים המסוכנים. כך שהתרופה השמידה תאי B בריאים ותאים סרטניים כאחד. אך מתברר שרוב בני האדם יכולים לחיות ללא תאי B. (אין הדבר נכון לגבי תאי T, כפי שאפשר לראות ממותם הטרגי של מיליוני אנשים שנדבקו בנגיף האיידס, התוקף תאי T.) ואחרי שהשפעת התרופה התפוגגה, רוב המטופלים התחילו בסופו של דבר לייצר שוב תאי B ממאגר תאי הגזע שבמח העצם שלהם. ניסויים קליניים בשנות ה-90 של העלו ששילוב של כימותרפיה וריטוקסימאב יעיל במיוחד נגד סוגי סרטן שפוגעים בתאי B.
הלויקמיה של קוהלר התחילה בתאי B שעברו מוטציה, אבל ריטוקסימאב גרם לה לתופעות לוואי קשות ונראה היה שהתרופה יעילה רק באופן חלקי ולכן היא הפסיקה ליטול אותה. בנוסף, בדיקות הראו שהסרטן שלה עמיד לכימותרפיה המקובלת. מכיוון שמצבה החמיר במהירות, הציעו לה הרופאים אימוּנוֹתֶרַפְּיָה ניסיונית שנועדה להילחם בסוג הלויקמיה שלה. היא הסכימה.
מטרת הטיפול החדש הייתה להרוס את כל תאי B של קוהלר, כמו באמצעות ריטוקסימאב, אבל בשני הבדלים עקרוניים. יעד המתקפה היה חלבון אחר על תאי B (הקרוי CD19). ובמקום להשתמש בתרופה נוספת כדי לסמן את חלבון המטרה בעבור תאי T שכבר מצויים בגופה של קוהלר, נקטו הרופאים גישה ישירה יותר. הם הוציאו חלק מתאי ה-T שלה, ושינו אותם מבחינה גנטית כך שיתקפו באופן אוטומטי את CD19, בלי עידוד נוסף.
חוקרים מכנים תאי T מהונדסים אלו תאי CAR-T (תאים בעלי קולטן כימֶרי לאנטיגֶן). לתאים אלו יש מאפיינים הן של תאי T והן של תאי B בדומה ליצורים המיתולוגיים העתיקים הקרויים כימֶרות והם שילוב של חיות שונות. טיפולי CAR-T עדיין ניסיוניים, אבל מִנהל המזון והתרופות האמריקני (FDA) צפוי לשקול את אישורם לשימוש כללי בשנה הבאה.
תאי CAR-T שתוכנתו להכיר את CD19 התרבו מהר כל כך בגופה של קוהלר, עד ששקית אחת של תאים מהונדסים שקיבלה ב-10 בפברואר 2015, חיסלה את כל תאי B שלה. אך שלא כמו אצל מטופלים אחרים, היה נראה שהגוף שלה שכח כיצד לייצר תאי B בריאים. למרבה המזל, אפשר לעקוף את הבעיה: מדי חודש היא מקבלת עירוי, שאורך כמה שעות, של נוגדנים מלאכותיים המכונים גאמא-גלובולין, כדי לעזור להגן עליה מפני מחלות זיהומיות. העירויים גוזלים זמן, היא אומרת, אבל "זה לא כימותרפיה, אז אני מעדיפה את זה."
אבל הטיפול ב-CAR-T גרם לקוהלר לתופעה שעלולה להיות גרועה מן הבחילות שמעוררת כימותרפיה: סערה הקרויה תסמונת שחרור ציטוקינים. התגובה הזאת מתרחשת כשתאי T רבים מן הרגיל מופעלים בבת אחת, וגורמים לשיטפון של אותות כימיים, הקרויים ציטוקינים, המשמשים את מערכת החיסון לצורכי תקשורת. התוצאה עשויה להיות פעילות מוגברת ומסכנת חיים שבה תאי מערכת החיסון הורסים רקמות בריאות וגורמים לכשל רב מערכתי.
אצל קוהלר, הסערה הייתה מהירה ורבת־עוצמה. היא הרגישה נורא שעה לאחר שקיבלה את תאי ה-T המהונדסים שלה. באותו לילה היא כבר הייתה בטיפול נמרץ, ונשארה שם שמונה ימים כשמחצית מן הזמן היא הייתה מחוסרת הכרה. היא אינה זוכרת מה קרה אבל יכולה להיזכר בהזיות שהגיעו כמה ימים לאחר מכן כשביקשה מן האחיות לעזור לה לארוז ארוחת צהריים בשביל שני שחקני גולף מפורסמים. קוהלר מכורה לגולף מ-1999, אז החלה לשחק כדי להכיר בני זוג, ובכללם הגבר שנישאה לו בסופו של דבר.
כשקוהלר השתחררה מבית החולים בתחילת מארס 2015, היא הייתה חלשה מאוד אך התאוששה במהירות. בדיקת מח עצם לא גילתה זכר לסרטן, ושלושה שבועות לאחר מכן היא חזרה למסלול הגולף עם בעלה. סופת הציטוקינים הייתה איומה, אך שלא כמו כימותרפיה, ההשפעות שככו בתוך כמה שבועות ולא גרמו לנשירת שיער. למרבה המזל, לנוכח העובדה שסופות ציטוקינים שכיחות באופן יחסי בטיפולי CAR-T, רופאים החלו ללמוד עד לאן אפשר להרחיק לכת עם מטופלים כמו קוהלר כדי להפיק את התועלת הגדולה ביותר בלי לסכן את חייהם.
טיפולי CAR-T מיוצרים בהתאמה אישית לכל מטופל. זה אתגר גדול וגם יקר מאוד לייצר טיפולים כאלה לכל חולי הלויקמיה והלימפומה שעשויים לרצות בכך. כרגע מוקדם מדי לדעת מה בדיוק יהיה מחיר טיפולי CAR-T, כי עד כה הם שימשו רק למחקר אקדמי. רוברט פרֶטי, המייסד של PCT, יצרנית CAR-T, מנסה לשפר את תהליך הייצור. הוא סבור שמדובר בעיקר בבעיות הנדסיות שייפתרו בתוך כמה שנים של עבודה קשה.
האתגר המשמעותי האחר העומד בפני טיפולי CAR-T הוא תרגום ההצלחה מגידולי סרטן נוזליים לגידולים מוצקים, מן הסוג שיוצר גושים בשד, בערמונית, בריאות, בעור או ברקמות אחרות. אבן נגף אחת היא שתאי CAR-T מתקשים לצאת ממחזור הדם ולאתר גידול מוצק, מסביר אירה מֶלמַן, סמנכ"ל אימונולוגיה של סרטן בגֶ'נֶנטֶק. בדם, תאי הגידול הנוזלי קלים יחסית לאיתור. חשוב אף יותר, בשעה ש-CAR-T יכול לחסל את כל תאי B בסרטני דם ולימפה, אין תאים דומים בגידולים מוצקים שהמטופלים יכולים להתקיים בלעדיהם.
מצב מוצק
גידולים מוצקים מציבים קשיים אחרים לטיפולים אימונולוגיים. הגידולים מוקפים לרוב במערך של רקמת חיבור ורקמות אחרות, החוסמות גישה של תאים אל הגוש הממאיר. בנוסף, הלחץ הפנימי של הגידול המוצק גבוה לרוב מן הלחץ של סביבתו, ובשל הפרשי הלחצים נשטפים החוצה אותות כימיים שמערכת החיסון משתמשת בהם כדי לתייג תאים פגומים, ואין צריך לומר תרופות רבות.
ואולם, גם גידולים אלו פגיעים. ב-2011 מנהל המזון והתרופות האמריקני (FDA) אישר נוגדן חד־שבטי, איפִּילימוּמַאב, כדי לטפל במקרים מתקדמים של מלנומה. שלא כמו בטיפולים מסורתיים, איפִּילימוּמַאב אינו אמור להשמיד באופן ישיר את תאי הסרטן, אלא לשחרר את המעצורים הביולוגיים שבהם משתמשים גידולים סרטניים מסוימים כדי לעכב את מערכת החיסון. התוצאה היא שמערכת ההגנה של הגוף יכולה כעת לפעול ביתר יעילות.
למלנומה יש הרגל מגונה: היא מרמה את תאי מערכת החיסון. לגושי התאים הסרטניים יש מגוון חלבונים פגומים על פני השטח, שתאי T אמורים לזהות ולהרוס לפני שהסרטן מצליח לגדול. אבל מדי פעם תא סרטני חדש מפתח דרך לשלוח אותות כימיים שאומרים לתאי T שהכול בסדר ואין צורך לתקוף.
למעשה, התאים הסרטניים חטפו מרכיב תקין של מערכת החיסון: מנגנון ביטחון שממתן את תאי ההגנה המשתוללים של הגוף לפני שיתחילו להרוס רקמות בריאות. ליתר דיוק, מנגנון ביטחון זה מורכב מסדרת נקודות בקרה שמפעילות או מרגיעות תאי הגנה, בהתאם לאותות הכימיים הקיימים. (אם חלבוני בקרת מערכת החיסון ייתקעו אי פעם במצב "פתוח", יש להניח שהתגובה החיסונית תהרוג אותנו מהר יותר מכל גידול סרטני.) באמצעות ייצור חלבונים שחוסמים את מערכת הבקרה, תאים סרטניים מונעים ממערכת החיסון לתקוף את הסרטן. חסימת האות הכוזב הזה בעזרת איפִּילימוּמַאב או מעכבים אחרים של חלבוני בקרה, מעירה מחדש את תאי מערכת החיסון ומאפשרת להם להתמקד שוב במטרה.
עד מהרה התברר שאיפִּילימוּמַאב יעיל לא רק במלנומה אלא גם בסרטן ריאות, וחברות תרופות החלו לפתח תרופות נוספות שמשתמשות באותה אסטרטגיה. נשיא ארה"ב לשעבר, ג'ימי קרטר בן ה-91, שהמלנומה שלו התפשטה למוחו, קיבל את אחת התרופות האלה, פֶּמְבְּרוֹלִיזוֹמַאב, ובשלהי 2015 הוא הכריז שהתרופה סילקה את כל הגידולים שלו.
בויאר, שקיבלה טיפול דומה במחלה דומה, לא זכתה לתוצאה טובה כל כך. וזוהי החידה. מקצת החוקרים משערים שגילו המתקדם של קרטר עזר לו. תאי סרטן זקנים צוברים יותר מוטציות, כך שייתכן שמערכת החיסון שלו הייתה צריכה דחיפה קטנה בלבד כדי לשחרר את תאי ה-T שכבר היו שם. לעומת זאת, ייתכן שאצל מקצת החולים, תאי T כלל לא הגיעו לגידול, וממילא לא היה מעצור שדרש שחרור. אצל חולים אחרים, עושה רושם שתאי T מצויים אמנם במקום הנכון אבל התרופה עדיין אינה פועלת, אולי כי יש צורך לשחרר כמה מעצורים שונים. מחקר מ-2015 שהתפרסם בכתב העת לרפואה של ניו אינגלנד הראה ששיעור גבוה יותר של חולי מלנומה הגיבו כשהם קיבלו שני מעכבים של חלבוני בקרת מערכת החיסון, במקום אחד.
ועדיין, רופאים מתקשים לחזות מי יגיב לאיזה מעכב או לאיזה שילוב של טיפולים, ולכן בויאר ומטופלים כמותה צריכים להמשיך ולהתנסות בתרופות שונות. כיום, קצת יותר מ-20% מן החולים במלנומה מתקדמת שמשתתפים בניסויים קליניים זוכים לתגובה מלאה מטיפול במעכבים של חלבוני בקרת מערכת החיסון, וקצת יותר ממחצית החולים זוכים לתגובה כלשהי. כדי לסבך את המצב עוד יותר, חלק מן הגידולים הסרטניים שנראה שנמשכים אליהם רק מעט תאי T עדיין מגיבים למעכבים של חלבוני הבקרה, ואילו לפעמים, בגידולים אחרים שמכילים הרבה תאי T דווקא, התרופות אינן משפיעות כלל. כלומר, ייתכן שלסרטן יש תחבולות אחרות.
משום כך בחירת טיפול יעיל בגידול מוצק של אדם מסוים היא עניין של ניסוי וטעייה, כפי שמלמד ניסיונה של בויאר. שנתיים לאחר הניתוח להסרת השוּמה הסרטנית מגבה, היא קיבלה את הבשורה המרה שהמלנומה חזרה ושהיא התפשטה לריאותיה ולבית החזה. מכיוון שהגידולים כעת היו גדולים מדי לניתוח, בויאר הסכימה להשתתף בניסוי קליני בתחילת 2013 שבו אמורים היו להזריק לה מינונים גבוהים של אינטרלוקין 2 (IL-2), אחד מתריסר כימיקלים שונים שעוזרים להגביר את יכולתה של מערכת החיסון להילחם בסרטן. תחילה, נראה היה שהתרופה עצרה את הגידול הסרטני, אבל לאחר שלושה חודשים הראו הסריקות שהסרטן ממשיך להתפשט.
בויאר עברה לניסוי קליני שני, שבו זיווגו את איפִּילימוּמַאב, המעכב של חלבון בקרת מערכת החיסון שאושר לא מכבר, עם מולקולת איתות אחרת של מערכת החיסון, IL-21. ואולם, בתוך כמה שבועות היו תופעות הלוואי של IL-21 (בחילות, שלשולים וכאבים בלתי נסבלים) חמורות כל כך עד שבויאר נאלצה להפסיק לקבל את הזריקות, והמשיכה לקבל רק איפִּילימוּמַאב. עד סוף 2013, חלק מן המוקדים הסרטניים החלו להתרחב, כך שהרופאים שלה המליצו על הקרנות כדי לעכב את הגדילה. בסתיו של השנה שלאחר מכן חלק מן הגידולים הצטמקו, אבל אחרים צצו בראשה ובְּחזַהּ.
הגידול בחזה הוסר בעזרת ניתוח, ושני טיפולים נוספים המחזקים את מערכת החיסון הצליחו לשלוט בשאר הגידולים לפרק זמן כלשהו. אבל בינואר 2015 היה כבר ברור שיש צורך בתכנית פעולה אחרת, משום שמוקדים חדשים החלו להופיע במוח, בחזה ובבטן. חודש לאחר מכן היא הצטרפה לניסוי קליני ששילב מעכב אחר של חלבון בקרת מערכת החיסון עם תרופה שאמורה להאט צמיחת גידולים. בזמן שמאמר זה ירד לדפוס, המוקדים הסרטניים של בויאר נותרו יציבים וחלק מהם הצטמקו מעט.
אין חולק על כך שטיפולים כה רבים פגעו בגופה של בויאר. היא מבלה את לילותיה ורבים מימיה על ספה נוחה בשל כאבים בגבה. במרבית הבקרים באותם שבועות שבהם היא אינה מקבלת את מחזור הטיפול הנוכחי, השישי שלה, היא עובדת כמהנדסת בניין. בשאר הזמן היא משחקת משחקי וידאו, והאהוב עליה הוא Call of duty. אבל אין היא מתחרטת על כך שניסתה שישה טיפולי אימוּנוֹתֶרַפְּיָה שונים עד כה. "נראה לי שחלק מן הטיפולים האלה האטו במקצת את הגידול," היא אומרת. אחד הרופאים שלה, נזכרת בויאר, "אמר שחלק מן המשחק במלנומה אינו בהכרח מציאת הטיפול הנכון כעת, אלא להישאר בחיים עד שימצאו את הטיפול הנכון."
מבט לעתיד
מכיוון שבויאר ומטופלים אחרים חיים די זמן כדי להרגיש קצת סיפוק, מֶלמָן מגֶ'נֶנטֶק נרגש. לגבי אימוּנוֹתֶרַפְּיָה, החלו לצוץ אפשרויות שהופכות לתוצאות ממשיות במטופלים, הוא אומר. חוקרים כבר אינם מוטרדים מן השאלה אִם המחקר שלהם יצליח לעזור למישהו בסופו של דבר. כעת הם פועלים כדי לשפר טיפולים שהוכחו כיעילים. "אנחנו צריכים לגלות את הגבולות והמגבלות ולהבין כיצד לעקוף אותם," אומר מֶלמָן, אבל "זוהי דרך מעוררת השראה ומרתקת לעשות מדע."
בסופו של דבר תהליך בחירת האימוּנוֹתֶרַפְּיָה ייעשה יותר לוגי, הוא סבור. חולה עם גידול מוצק יעבור תחילה ביופסיה כדי לחפש תאי T. אם יהיו די תאי T בגידול, המטופל יקבל מעכב אחד של חלבון בקרה של מערכת החיסון, או אולי אפילו כמה מעכבים. (עד כה ה-FDA אישר שלושה מעכבים של חלבוני בקרה, אבל יותר מתריסר מצויים בפיתוח.) אם הגידול עדיין לא משך אליו תאי T רבים, רופאים ינסו אולי שיטות אחרות הן כדי להניע את תאי מערכת החיסון והן כדי להפנות את תשומת לבה של מערכת החיסון לגידול לפני שיפתחו את נקודות הבקרה.
חוקרים שוקלים גם כיצד להשתמש בטיפולים שגרתיים, ובכללם הקרנות וכימותרפיה, כדי לעורר את התגובה החיסונית. השמדת כמה תאים סרטניים בעזרת מינונים נמוכים יותר של כימותרפיה או קרינה אמורה לשחרר כמויות גדולות של שברי תאים מן הגידול, ולהתריע בכך בפני מערכת החיסון לשלוח תאי T אל שרידי הגידול שנותרו. (ייתכן שיהיה קשה להשיג את האיזון הנכון כי יותר מדי כימותרפיה והקרנות גם מדכאים חלקים של מערכת החיסון.) ואז, הוספת מעכב של חלבון בקרה עשויה לאפשר מלחמה יעילה בגידול המוחלש לפני שתהיה לו הזדמנות להתאושש. אבל מדענים רק החלו לבחון השערות אלו.
ולבסוף, ככל שה-FDA מאשר יותר סוגי אימוּנוֹתֶרַפְּיָה נוצר אתגר אחר לגמרי ולא רפואי: המחיר. שילוב תרופות מעלה את המחיר של טיפולים שגם כך הם יקרים למדי. השוק העולמי לתרופות אונקולוגיות מתקרב כבר ל-100 מיליארד דולר בשנה, על פי חברת הנתונים הרפואיים IMS Health, אבל בכירים בחברות תרופות מבינים שחברות הביטוח והציבור לא יהיו מוכנים או לא יוכלו לשלב תרופות ללא הגבלה במחירים שעשויים להגיע ל-150,000 דולר או יותר למטופל. כעת בוחנים, בין השאר, שיפורים בייצור התרופות, מינונים נמוכים יותר ופרקי טיפול קצרים יותר, כדי להוזיל את הטיפולים.
ועם זאת, הטיפולים המצויים כיום רחוקים מלהיות מושלמים. קוהלר עדיין מרגישה את השפעות הטיפול. היא מתעייפת בקלות רבה יותר מבעבר. כשהיא יוצאת לארוחת צהריים עם חברים, לא תמיד יש לה מרץ לצאת להליכה עם בן זוגה. "החלק הקשה ביותר זה עד כמה לדחוף את עצמי," היא אומרת. אבל קוהלר מסוגלת ליהנות מכך שפרשה מן העבודה לאחר שהטיפול הראשון לא הועיל. היא משחקת גולף, מטיילת או הולכת בשלג כשמזג האוויר מאפשר זאת. היא קיבלה השראה מכלבי הטיפול שביקרו אותה במהלך האשפוז, והיא מביאה את סיג'יי, הגולדן רטריבר שלה, לבית הספר המקומי כדי לעזור לתלמידים להפיג מתחים בזמן בחינות. אונקולוגים סבורים שאימוּנוֹתֶרַפְּיָה תאפשר להם בקרוב להעניק למטופלים רבים יותר הזדמנות ליהנות מחדש מן החיים.
חיסון לסרטן?
התמקדות בתאי סרטן על ידי שימוש בדנ"א שלהם עצמם יכולה לעזור לחסל גידולים סרטניים ולמנוע הישנות של המחלה.
מאת ביאטריס מ' קרנו ואיליין ר' מרדיס
יותר מעשור ניסו חוקרים לחמש את מערכת ההגנה האנושית נגד סרטן בעזרת חיסונים. זריקות אלו לא תוכננו למנוע סרטן מלכתחילה, אלא לספק למערכת החיסון של החולים מידע כיצד נראה האויב, כלומר תאי הסרטן. באופן כללי, תאי סרטן אינם נראים שונים בהרבה מתאים תקינים כדי לגרום לתגובה חיסונית, אבל מצאנו דרכים להדגיש ולסמן כמה חלבונים ייחודיים לתאים ממאירים.
תאים אנושיים מצופים במה שמכונה חלבונים־עצמיים ההמשמשים כסמני זיהוי למערכת החיסון. כמו תעודת זהות, הם מאפשרים לגוף לדעת אם חומר כלשהו שייך לגוף ואין לתקוף אותו. למרבה הצער, חלבונים אלו מצויים גם על פני השטח של תאים סרטניים. ניסיונות מוקדמים יותר של הקבוצה שלנו ושל אחרים לפתח תרכיבים כשלו כנראה כי הם עודדו את מערכת החיסון לחפש חלבונים המצויים על פני שני סוגי התאים, אם כי ברמות שונות.
ואולם, לאחרונה הצליחה הקבוצה שלנו להתמקד בחלבונים ייחודים לתאים ממאירים, בעזרת סריקת רצף הגֶנום של תאים תקינים ושל תאים ממאירים כדי לזהות חלבונים ייחודיים לסרטן. לאחר מכן אנחנו בודקים אילו חלבונים ייחודיים לסרטן גורמים לתגובה חזקה של מולקולות חיסוניות האמונות על הכוונת תגובת הגוף לחומרים זרים. מולקולות אלו קרויות חלבוני מערך התאמת הרקמות (MHC). בעזרת מידע זה אנחנו יכולים ליצור תרכיבים מותאמים בהתאמה אישית הכוללים תאים דנדריטיים ממערכת החיסון של החולה, ומכילים חלבוני MHC שייצמדו לחלבוני הסרטן ויציגו אותם למערכת החיסון. אות זה עוזר לייצר תגובה אנטי־סרטנית של תאי T ומייעד להשמדה את תאי הסרטן הנושאים חלבונים מסוימים אלו.
ב-2015 ניסינו את הגישה הזאת עם שלושה חולי מלנומה. כפי שכתבנו במאמר בכתב העת סיינס, גילינו שבעה חלבונים ייחודיים לסרטן שייקשרו למולקולות ה-MHC של כל חולה. שלושה מתוך שבעת החלבונים זוהו על ידי תאי ה-T של החולים, ותאי T אלו תקפו את תאי הסרטן.
שנה לאחר מכן מערכת החיסון של החולים המשיכה לייצר תאי T אנטי־סרטניים במחזור הדם, ממצא שמעיד על כך שהחיסונים שלנו עשויים למנוע הישנות של המחלה. (אצל שניים מן החולים הגידולים התכווצו או התייצבו, אבל מכיוון שהם קיבלו טיפולים נוספים, איננו יודעים מה עזר.) כיום, כל השלושה חיים ויציבים ואין להם תופעות לוואי שליליות מהחיסון.
המחקר שלנו מצוי עדיין בשלבים מוקדמים. התמקדנו תחילה במלנומה כי זה סרטן עם הרבה מוטציות ויעדים חלבוניים, אבל אנחנו מתעתדים לבחון את הגישה גם עם סוגי סרטן אחרים. לפני שהשיטה שלנו תהפוך לחלק שגרתי מן הטיפול בסרטן, נצטרך לבדוק כיצד היא משפיעה על גידולים בטווח הרחוק ולקצר את זמן הכנת התרכיבים. בסופו של דבר המטרה היא להשתמש בתרכיבים אלו כדי לסייע לטיפולים אחרים בסרטן. אנחנו מקוות שהתרכיבים יעניקו לחולים סיכויים טובים יותר במלחמה בסרטן.
ביאטריס מ' קרנו היא פרופסורית עמיתה לרפואה באוניברסיטת וושינגטון בסנט לואיס. איליין ר' מרדיס היא פרופסורית לרפואה ע"ש רוברט א' ולואיס כ' דן ואחת ממנהלות מכון מקדונל לגֶנום באוניברסיטת וושינגטון בסנט לואיס. שתיהן חוקרות את האופן שבו אימונולוגיה של האדם וגֶנומיקה של הסרטן עשויות לשפר את הטיפול בסרטן.
מלחמת חיידקים
סוגים מסוימים של חיידקי מעי יכולים לחזק את יכולתו של הגוף להילחם במחלות ממאירות
מאת מריה-לואיזה אלגרה ותומס פ' גז'וסקי
מדוע חלק מן המטופלים מגיבים טוב לסוגים החדשים של אימוּנוֹתֶרַפְּיָה לסרטן, ואילו אחרים לא? ייתכן שלמרכיבים הגנטיים של גידולי המטופלים יש חלק בכך. ואולם, המחקרים שלנו ושל מדענים אחרים מעידים כעת שיש תפקיד גם להבדלים במיקרוביום של המטופלים, אותם חיידקים ידידותיים ששוכנים בחלקים שונים של גופנו.
קהילות החיידקים האלה, בייחוד אלה המצויות במעי, יכולות להכיל מיני חיידקים שונים. מינים אלו, בתורם, משפיעים על עוצמת התגובה הדלקתית של מערכת החיסון של הפונדקאי במנגנונים שעדיין אינם מובנים לנו לגמרי. יש חיידקים הגורמים לתגובת־יתר דלקתית הגורמת לתאים רגילים להפוך לסרטניים או שמאמנת בטעות תאים של מערכת החיסון לתקוף רקמות בריאות במפרקים, כמו בדלקת מפרקים שגרונתית.
לפעמים חיידקים יכולים גם לעורר תגובה חיסונית טיפולית. קבוצת המחקר שלנו, באוניברסיטת שיקגו, חקרה עכברים זהים מבחינה גנטית שהיה להם מיקרוביום שונה מאחר שהם גודלו בסביבות שונות. לאחר שהוזרקו לעכברים תאים מסרטן העור מלנומה, הגידולים צמחו באִטיות בקבוצה אחת ומהר יותר בשנייה. בעכברים שאצלם הגידולים צמחו לאט הייתה גם תגובה חיסונית חזקה יותר כנגד הגידול. באופן מרשים, השתלת המיקרוביום מן החיידקים עם הגידולים האִטיים בקבוצת העכברים השנייה – שנעשית בהעברת צואה בין החיות – האטה את צמיחת הגידולים גם בקבוצה השנייה.
בניתוח הדנ"א בדגימות הצואה של שתי קבוצות העכברים, הקבוצה שלנו גילתה שני מיני חיידקים מסוג Bifi dobacterium שאחראים, ככל הנראה, לשיפור הפעילות האנטי־סרטנית. די בהזנת העכברים בזן אחד של חיידקים, או Bifi dobacterium longum או Bifi dobacterium breve כדי לעורר את מערכת החיסון ולהאט את צמיחת הגידולים בעכברים. הנוכחות של חיידקים מיטיבים אלו אפילו קבעה את היעילות של אימוּנוֹתֶרַפְּיָה חדשה (ראו כתבה מרכזית). הגידולים נעלמו לגמרי בעכברים שטופלו במעכב חלבון בקרת מערכת החיסון והמיקרוביום שלהם כלל את מיני הביפידובקטריום. ואילו עכברים ללא חיידקים אלו חוו רק תגובה חלקית לתרופה אבל החלימו אם הזינו אותם גם בזני החיידקים הנכונים.
קבוצה אחרת של חוקרים, בעיקר בצרפת, ערכה ניסוי דומה עם מעכב אחר של חלבוני בקרה. הם מצאו שסוג חיידקים אחר, Bacteroides, מאפשר לעכברים להעלים את הגידולים המוזרקים. כשנתנו לחיות אנטיביוטיקה שהרגה את החיידקים, התרופות האנטי־סרטניות איבדו את יעילותן, ממצא שאמור לעניין רופאים לנוכח המספר הרב של חולי סרטן המקבלים אנטיביוטיקה. תוצאות המחקרים של קבוצות המחקר בצרפת ובשיקגו פורסמו בנובמבר 2015 בכתב העת סיינס.
ברור שיש צורך להיטיב לסווג את החיידקים במיקרוביום האנושי ואת ההשפעות האנטי־סרטניות המשוערות שלהם לפני שנוכל להמליץ על טיפולים כלשהם לבני אדם. בשעה שחיידקים כמו ביפידובקטריום משפיעים כנראה לטובה, זנים אחרים עשויים לאפשר לגידולים לצמוח מהר יותר. (גם צריכת יוגורט כדי לחזק את מערכת החיסון עשויה לא לפעול. יוגורט מכיל לרוב חיידקי ביפידובקטריום לקטיס או ביפידובקטריום ביפידום, וייתכן שאין להם אותה השפעה כמו הזנים במחקרי העכברים.) רופאים גם לא ירצו לחזק את מערכת החיסון יותר מדי כדי לא לגרום למחלות אוטואימוניות.
מריה-לואיזה אלגרה היא פרופסורית במחלקה לרפואה באוניברסיטת שיקגו. תומס פ' גז'וסקי הוא פרופסור במחלקה לפתולוגיה ובמחלקה לרפואה באוניברסיטת שיקגו.