במאמר הנוכחי אני רוצה לעבור על הדרך בה פותחו החיסונים של פייזר ומודרנה, כיצד זכו לאישור החירום, ומה המשמעות בסופו של דבר על רמת הבטיחות והיעילות שלהם. כדי לעשות זאת נעבור על כל שלב בתהליך טיפוסי של פיתוח ואישור חיסונים, ונראה איך הוא התנהל בשנה האחרונה
מהרגע שהחיסונים קיבלו את אישור ה- FDA, החלו התהיות לעלות ברחבי הרשת החברתית: האם הם באמת אושרו לשימוש?
התשובה היא שכן: הם אושרו. ולא, הם לא אושרו.
נעשה סדר.
הסיבה לבלבול מגיעה מכך שה- FDA משתמש בשני מונחים שונים באנגלית, שבעברית נשמעים אותו הדבר. הראשון הוא Approval – כלומר, אישור. נקרא לו מעכשיו "אישור רגיל". אם ה- FDA החליט שהמוצר יעיל ובטוח לשימוש – הרי שהוא מקבל אישור רגיל[i]. התהליך לקבלת אישור כזה ארוך במיוחד, ויכול להגיע בקלות ל- 245 ימים ואפילו יותר[ii].
הסוג השני של אישור נקרא באנגלית Authorization. או בשמו המלא – Emergency Use Authorization (EUA). נקרא לו מעכשיו "אישור חירום". ה- FDA מספק אישורי חירום במצבים יוצאי-דופן, בהם יש צורך דחוף בתרופות או מתקנים רפואיים שיכולים להציל חיי אדם, ושהסיכון הכרוך בשימוש בהם זעום. מצב, למשל, בו נגיף חדש מסתובב בעולם, קוטל מיליוני אנשים, גורם לתופעות לוואי שאינן מובנות לנו ועל הדרך גם גורם לשיתוק של מדינות שלמות[iii].
נכון להיום, חברות החיסונים קיבלו רק אישור חירום מה- FDA. ולמרות העובדה שלא מדובר באישור רגיל, ההמלצה הגורפת לכל המבוגרים (מלבד יוצאי-דופן נדירים) היא להשתמש בחיסון בלי לחשוב פעמיים.
כאן עולים החשדנים ושואלים – בצדק מוחלט – איך זה? הרי תהליך פיתוח של חיסון רגיל יכול בקלות לארוך 10-15 שנים[iv]. ולמרות שבמהלך השנים היו כמה יוצאי-דופן חריגים – חיסונים לשפעת האסיאתית, שפעת החזירים ושפעת הונג-קונג שפותחו תוך שישה חודשים או פחות – הרי שהם אושרו במהירות בדיוק מכיוון שהיה חשש גדול ממגפה עולמית[v]. אלו לא בדיוק הדוגמאות שהיינו רוצים להסתמך עליהן, אם היינו רוצים לטעון שהחיסון לקורונה בטוח ויעיל.
במאמר הנוכחי אני רוצה לעבור על הדרך בה פותחו החיסונים של פייזר ומודרנה, כיצד זכו לאישור החירום, ומה המשמעות בסופו של דבר על רמת הבטיחות והיעילות שלהם. כדי לעשות זאת נעבור על כל שלב בתהליך טיפוסי של פיתוח ואישור חיסונים, ונראה איך הוא התנהל בשנה האחרונה.
שלב ראשון: המחקר
בשלב זה צריכים חוקרים במעבדות לזהות חומר מסוים שעשוי להיות בעל פוטנציאל לחיסון, לאפיין אותו, להבין כיצד הוא פועל ולשכנע את המנהלים או את חברות התרופות ששווה להן לקחת את הסיכון ולנסות לקבל עליו אישור מה- FDA – תהליך שדורש עשרות-מיליוני דולרים. בסך הכל נמשך שלב זה בין שנתיים לארבע שנים.
כאשר חברות ניסו לייצר חיסונים בעבר, הן היו צריכות לבודד את הנגיפים, ואז להרוג אותם – או לפחות להחליש אותם מאד. בדרך זו, הגוף היה מפתח חסינות כנגדם, מבלי שהנגיפים היו יכולים לפגוע בו. הצרה היא שאם אנחנו סתם הורגים את הנגיף לפני שמזריקים אותו לגוף, הרי שהוא עלול להתפרק – ואז הגוף לא יפתח חסינות כנגדו. ואם אנחנו לא מחלישים את הנגיף מספיק, הרי שהוא יגרום למחלה בעצמו. החלשת נגיפים היא אומנות בפני עצמה, ויכולה לקחת שנים ארוכות. ואם כבר הצלחתם להחליש את הנגיף ולהזריק אותו לגוף, אזי מערכת החיסון תפתח מאות ואלפי נוגדנים כנגד כל האזורים על פני השטח של הנגיף שהיא תזהה. אחד מאותם נוגדנים עלול לזהות בטעות דווקא תאים אנושיים כאויבים… ומכאן קצרה הדרך למחלה אוטו-אימונית, בה הגוף תוקף את עצמו, ואף אחד לא יוצא טוב מהמלחמה הזו.
בקיצור, כאב ראש, וכזה שלוקח שנים לפתור.
אבל כאן קרה דבר מופלא.
פייזר ומודרנה השתמשו בטכנולוגיות החדשניות ביותר בביולוגיה כדי לסקור את מבנה הנגיף ואת הקוד הגנטי שלו – משימות שבסוף המאה העשרים היו דורשות שנים – וזיהו אתר מסוים (חלבון הספייק) על פני הנגיף שהן האמינו שנוגדנים ייקשרו אליו היטב. לאחר מכן הן זיהו את ההוראות בקוד הגנטי של הנגיף בזכותן הוא היה יכול לייצר את אותו חלבון ספייק. ובסוף, הן שכפלו את אותן הוראות כך שיופיעו בגדיל קצר של רנ"א – חומר שנמצא בתאים בשפע. הרנ"א היה אמור להיכנס לתאים ולגרום להם לייצר את חלבון הספייק ולהציג אותו על פני השטח שלהם כדי שמערכת החיסון תלמד להכיר אותו ולפתח עמידות כנגדו.
כמה זמן ארך כל התהליך הזה? במודרנה טוענים שהוא לקח להם יומיים בסך הכל[vi]. הם כנראה מגזימים, אבל לא בהרבה. תהליך שהיה לוקח שנים בעבר – נעשה בשנת 2020 בימים ספורים.

שלב שני: השלב הפרה-קליני
חברות התרופות מגיעות לשלב השני במסלול עם החיסון שלהן, ורוצות לעשות איתו ניסויים קליניים בבני-אדם. אלא שלפני שמרשים להן אפילו להתקרב לאנשים עם מזרק, החברות חייבות לבחון את החומר על שני מינים לפחות של בעלי-חיים כדי לוודא שהוא אינו גורם לנזק.
כל המידע מהניסויים הללו – שנקראים ניסויים פרה-קליניים (כלומר, "לפני הקליניים") – עובר לוועדה שבוחנת אותו בקפידה. הוועדה הזו לא עושה הנחות לאף אחד. אם החברה עיגלה פינות, למשל, ובחרה לערוך ניסוי אך ורק על עכברים זכרים למרות שיש חשש שהחומר הנבדק עלול לגרום לעיכובים התפתחותיים בעובר, הוועדה תזרוק את החוקרים מכל המדרגות בחזרה למעבדה, ותדרוש שיראו לה ניסויים גם בנקבות, או בבעלי-חיים שפגיעים במיוחד לחומרים מהסוג הזה.
השלב הפרה-קליני יכול לקחת בקלות שנה-שנתיים. אז איך הצליחו פייזר ומודרנה להשלים אותו במהירות שיא?
כאן אנו חוזרים לבחירה של החברות להשתמש בחיסוני רנ"א. רנ"א מתפרק במהירות בגוף, ולכן אין חשש מתופעות לוואי חמורות. נעשו גם שפע של ניסויים במעבדות בעבר בחיסוני רנ"א, שלא הראו שהוא משפיע לרעה על בעלי-חיים.
אבל החיסון אינו מורכב רק מרנ"א. הרנ"א הוא המסר הסופי שאנחנו שולחים לתאים, אבל כדי שיגיע לשם בבטחה, הוא צריך 'משאית' שתביא אותו ליעד. המשאית הזו היא מעטפת מחומר המכונה PEG (פוליאתילן גליקול לסטודנטים-לשעבר-שלי-מהפקולטה-להנדסה-ביו-רפואית-שהיום-כבר-יודעים-הרבה-יותר-ממני-בתחומים-האלה-ולא-אני-לא-מריר-בכלל-לגבי-זה). גם לגבי החומר הזה יש שפע של מחקרים מהעבר שמראים שהוא אינו רעיל לגוף במינונים נמוכים. כך שהסטנדרטים לניסויים הפרה-קליניים לא היו גבוהים מלכתחילה, כי הרעילות של כל החומרים הרלוונטיים ידועה.
פייזר ספציפית ביצעה ניסויים בעכברים ובקופי מקוק, בחנה את ההשפעה של החיסון עליהם לאורך 28 ימים, ומשלא התגלו סימנים לנזק – קיבלה אישור להתקדם לניסויים קליניים[vii]. אני מודה שהייתי רוצה לראות תוצאות מניסויים ארוכים יותר בבעלי-חיים – חודשיים או אפילו יותר – אבל אני מוכן להתפשר גם על מה שיש, אם המומחים מהוועדה של ה- FDA החליטו שזו תקופת זמן ארוכה מספיק כדי להיות בטוחים *מספיק* בבטיחות של החיסון. להחלטה הזו בוודאי היה קשר, שוב, לכך שגם חיסוני רנ"א וגם PEG כבר מוכרים היטב כבטוחים מעשר השנים האחרונות.
שלב שלישי: הגשת בקשה לפתיחה בניסויים הקליניים
בשלב זה מגישות החברות ל- FDA את בקשת ה- IND – Investigational New Drug. הן מתארות את הניסויים שערכו, את המבנה הכימי והביולוגי של החומר הנבדק, את הדרך בה יבצעו את הניסויים הקליניים, את דרכי הייצור של החיסון ועוד ועוד. בסך הכל מדובר בכמות מסמכים בעובי של אנציקלופדיה, וה- FDA מאשר או דוחה את המשך הניסויים תוך שלושים ימים[viii]. אני מנחש שבמקרה של החיסונים לנגיף הקורונה, ה- FDA הורה לכמה עשרות עובדים לעזוב הכל ולהתרכז במידע שהגישו פייזר ומודרנה כדי לאשר אותו תוך ימים ספורים.
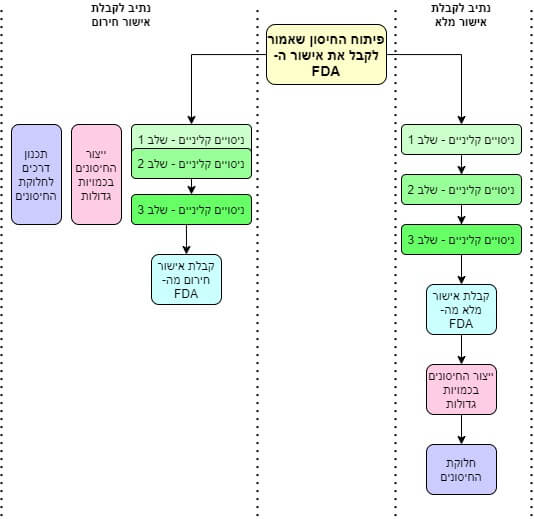
שלב רביעי: הפיצול הגדול
כאן יש שלב ששונה מאד בין שני סוגי האישורים – האישור הרגיל והאישור המהיר. באופן רגיל, החברות חייבות לבצע את הניסויים הקליניים ורק אז יכולות לקבל אישור (BLA) לייצר את החיסונים בכמויות גדולות[ix]. במצב חרום, החברות מקבלות אישור מיוחד להתחיל בהכנות לייצור החיסונים עוד במהלך הניסויים הקליניים. בזכות האישור הזה הן יכלו לפתוח מפעלים ולהתאים פסי ייצור מיוחדים לטובת החיסון החדש… עוד לפני שהוא בכלל אושר על-ידי ה- FDA. קיצור הדרך הזה חסך להן לפחות שנה, ובזכותו הן יכלו להתחיל לייצר את החיסון עוד לפני סוף 2020.
שלב חמישי: הניסויים הקליניים
וכאן, סוף סוף, הגענו לניסויים הקליניים. ישנם שלושה שלבים של ניסויים קליניים:
- שלב ראשון: ניסוי בעשרות מתנדבים, בריאים לגמרי, שנועד רק לבדוק שהחיסון אינו פוגע בהם ולקבוע את המינון האופטימלי עבורם.
- שלב שני: ניסוי במאות מתנדבים, שנועד לבדוק האם החיסון יעיל.
- שלב שלישי: ניסוי בעשרות-אלפי מתנדבים שנועד לוודא סופית שהחיסון יעיל ובטוח.
פייזר בחרה לאחד את השלב הראשון והשני של הניסויים הקליניים. לא מדובר כאן בנוהל יוצא-דופן. להפך: חברות רבות נוקטות בו. מודרנה הסתפקה בשלב הראשון בלבד. שתיהן בחנו רק 45 מתנדבים בניסויים הקליניים הראשוניים. הן שחררו את התוצאות באמצע יולי (מודרנה)[x] ובאמצע אוגוסט (פייזר)[xi]. בקיצור נמרץ: הכל בסדר.
ושוב, בנקודה זו החברות היו צריכות בימים כהרגלם להגיש את התוצאות ל- FDA לאישור, וכל התהליך היה לוקח בין חצי-שנה לשנה. אבל במגפה כמו במגפה, ה- FDA דחף את העניין לראש סדר העדיפויות שלו, ותוך זמן קצר מאד התקבל האישור לעבור לשלב השלישי.
בשלב השלישי נבדקו עשרות-אלפי מתחסנים. איסוף כמות כזו של משתתפים בניסויים לוקח חודשים ארוכים מאד ועולה הון-תועפות. הפעם, אנשים נהרו להשתתף בניסויים האלו מרצונם החופשי. עוד קיצור-דרך שהתאפשר בזכות המצב. פייזר ומודרנה חיסנו בערך מחצית מהמשתתפים, ואז שחררו אותם אל הטבע ועקבו אחריהם במשך עשרה שבועות (חודשיים וחצי) כדי לראות מי נדבק ומי לא.
חישבו לרגע על זה: בחיסונים רגילים – נאמר, נגד פוליו או הרפס – אתם צריכים לחכות עד שהמחוסנים שלכם יידבקו במחלות הללו. זה עלול לקחת שנים. אבל כשיש מגפה שם בחוץ, עם נגיף מדבק במיוחד? באותם עשרה שבועות בלבד נדבקו 170 משתתפים בניסוי של פייזר, ו- 196 משתתפים בניסוי של מודרנה. כמעט כל הנדבקים הגיעו מקבוצת הביקורת, בעוד שהמחוסנים כמעט לא נדבקו, ואלו שכן נדבקו – חלו באופן קל בלבד [xii] [xiii].
ומה לגבי תופעות הלוואי האפשריות? ובכן, יש סיבה למעקב של עשרה שבועות אחר המחוסנים. רוב תופעות הלוואי של חיסונים מופיעות עד לשבוע השישי מרגע מתן החיסון. ולמרות זאת, במהלך עשרת השבועות לא התגלו שום תופעות לוואי רציניות של החיסון. לכל היותר הופיעה תגובה אלרגית ב- 0.63 אחוזים ממקבלי החיסון… וב- 0.51% ממקבלי הפלצבו (כלומר, זריקה ללא חיסון). כיום, אחרי שעשרות מיליוני מנות חיסון ניתנו בכל העולם, אי אפשר עדיין למצוא תופעות לוואי קשות בתדירות גבוהה[xiv]. קיימים חשדות מסוימים שהחיסון עלול לגרום למחלת לב, אך אלו לא הוכחו ועדיין נחקרים. גם אם זה נכון – כנראה שמדובר בשכיחות של אחד מתוך כל מאה-אלף מחוסנים, בערך. ומכיוון שבלי החיסון כולנו היינו נדבקים בווריאנט הבריטי, ומכיוון שהסיכוי ללקות במחלה קשה גבוה הרבה יותר מאחד למאה-אלף, אישור החיסון עדיין מוצדק.
וזה סוף הסיפור: התוצאות מהניסויים היו מובהקות כל-כך, ותופעות הלוואי של החיסונים היו קלות כל-כך, שה- FDA סיפק את אישור החירום במהירות. ומכיוון שמפעלי החיסונים כבר נכנסו לפעולה עוד בתחילת הניסויים הקליניים, ברגע שהאישור הסופי הגיע, מיליוני מנות חיסונים נשלחו מיד למזמינים המוקדמים. אולי שמתם לב, כי כאן בישראל קיבלנו די הרבה מהן.
תיקון טעות לגבי השלב הרביעי בניסויים הקליניים
יש כאלו שמזכירים את "השלב הרביעי" בניסויים קליניים, וטוענים שהיינו צריכים להעביר את החיסונים דרכו. מדובר באי-הבנה. השלב הרביעי מכונה גם שלב ה- "בקרה לאחר שיווק"[xv]. כלומר, החברה וה- FDA ממשיכים לאסוף נתונים אודות המחוסנים, כדי לוודא שלא צצות תופעות לוואי בעייתיות. ההנחה אחרי השלב השלישי היא שהחיסון בטוח, אבל ליתר ביטחון – ממשיכים לעקוב אחר כל המחוסנים. גם אם החיסון היה מקבל אישור רגיל, השלב הרביעי היה מתחיל רק אחרי קבלת האישור.
ובכל זאת – למה אישור חירום?
בוודאי הבחנתם שאני אופטימי לגבי החיסונים. הם עברו את כל השלבים הנדרשים לקבלת אישור החירום, אחרי הכל. השלבים האלו היו דומים לאלו שעוברים חיסונים במצב רגיל כדי לקבל אישור רגיל. כך שכן – יש לי אמון מלא ביעילות ובבטיחות של החיסון בטווח הקצר.
אבל בטווח הארוך, אף פעם אי אפשר להיות בטוחים באמת. וזו הבעיה האמיתית: הניסויים בשלב השלישי היו קצרים יחסית, מכיוון שהראו תוצאות טובות כל-כך. זוהי ברכה, אבל היא גם מקשה עלינו לוודא שאין לחיסונים תופעות לוואי ארוכות-טווח. אז נכון – לא אמורות להיות להם תופעות לוואי ארוכות-טווח. אבל בביולוגיה אף פעם אי אפשר לדעת בוודאות של מאה אחוזים מה בדיוק עומד לקרות. לכל היותר אפשר לומר ש- "לפי כל מה שאנחנו יודעים על החיסון, אין שום סיבה שיהיו לו תופעות לוואי בטווח הארוך".
לא הרגיע אתכם? אני מבין לגמרי. כמו שאמרתי לכל אחד ששאל אותי בפרטי: הייתי מאד רוצה לראות ניסויים קליניים ארוכי-שנים עבור החיסון הזה, רק ליתר ביטחון.
אלא מה? עכשיו כבר ברור שמי שלא מתחסן, יידבק. ואם אדבק, הסיכויים שלי להגיע לבית-החולים גבוהים עשרות-מונים מהסיכויים לתופעות לוואי בטווח הקצר. ובניגוד לחיסון – אנחנו כבר יודעים שמי שנדבק מפתח פעמים רבות תופעות לוואי שמלוות אותו חודשים ארוכים, ואולי מעבר לכך.
במילים אחרות, מדובר בניהול סיכונים פשוט: מהצד האחד קיים הנגיף, שאנחנו יודעים שיכול לגרום לנזקים קשים לגוף, והסיכויים להידבק בו גבוהים מאד. מהצד השני קיים החיסון, שאנחנו יודעים בוודאות שאינו מזיק בטווח הקצר, ושאין לנו שום סיבה לחשוב שהוא מזיק בטווח הארוך.
במצב כזה, אני מעדיף את החיסון, למרות שהוא קיבל 'רק' אישור חירום.
וזה כל הסיפור מאחורי הטענות לגבי אישור החירום המוגבל. כן, הוא באמת מוגבל, אבל החיסונים עברו את כל שלבי הבדיקה שנדרשים גם לקבלת אישור רגיל. הם פשוט עברו אותם מאד, מאד מהר, וטוב מאד שכך. הסיכון לטווח-הארוך קיים, אבל הוא מזערי.
אני כבר קיבלתי את החיסון, ואני לא מתחרט. אישור החירום כאן מספיק בהחלט.
ד"ר רועי צזנה הוא חוקר עתידים, מרצה ומחבר הספרים "המדריך לעתיד ו"השולטים בעתיד"
[i] https://www.fda.gov/news-events/approvals-fda-regulated-products/about-fda-product-approval
[ii] https://www.qualio.com/blog/fda-medical-device-approval-process
[iii] https://www.fda.gov/emergency-preparedness-and-response/mcm-legal-regulatory-and-policy-framework/emergency-use-authorization
[iv] https://www.historyofvaccines.org/content/articles/vaccine-development-testing-and-regulation
[v] https://www.visualcapitalist.com/the-race-to-save-lives-comparing-vaccine-development-timelines/
[vi] https://www.businessinsider.com/how-moderna-developed-coronavirus-vaccine-record-time-2020-11
[vii] https://www.biorxiv.org/content/10.1101/2020.09.08.280818v1.full.pdf
[viii] https://www.fda.gov/drugs/investigational-new-drug-ind-application/ind-application-procedures-overview
[ix] https://www.fda.gov/vaccines-blood-biologics/development-approval-process-cber/vaccine-development-101
[x] https://www.nejm.org/doi/full/10.1056/NEJMoa2022483
[xi] https://www.nature.com/articles/s41586-020-2639-4
[xii] https://www.sciencemag.org/news/2020/11/absolutely-remarkable-no-one-who-got-modernas-vaccine-trial-developed-severe-covid-19
[xiii] https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-conclude-phase-3-study-covid-19-vaccine
[xiv] https://medshadow.org/covid19-vaccine-side-effects/
[xv] https://www.news-medical.net/health/What-is-a-Phase-4-Clinical-Trial.aspx
עוד בנושא באתר הידען:
