עבור המקרה של אבן-בניין חיונית לחלבונים – חומצת האמינו אלאנין (alanine) – הטבע היה זהיר במיוחד, ופיתח שתי נקודות ביקורת, ולא רק אחת, במטרה שהשימוש במרכיב חיוני זה יהיה מדויק. כעת גילו מדענים מדוע התופעה מתרחשת
כעת, מדענים ממכון המחקר Scripps, גילו את הבסיס הכימי לשאלה מדוע מאמצים כבירים אלו נדרשו. הממצאים פורסמו בכתב-העת המדעי Nature.
"מה שהראנו כאן, לגביי "פרדוקס הסרין" ('serine paradox'), הינו רק קצה הקרחון," אמר כותב המאמר הבכיר Paul Schimmel, פרופסור לביולוגיה מולקולארית וכימיה במכון סקריפס. "בשנים הקרובות, תהיה מודעות הולכת וגוברת לגביי התפקיד של תרגום שגוי בגרימת מחלות באדם וכיצד הטבע נאבק בכדי למצוא פתרונות להפחית את השפעותיהן של שגיאות אלו."
כפי שאותיות האלפבית מגדירות מילים, כך חומצות אמינו, הקשורות אחת לשנייה בסדר מסוים, מגדירות, בסופו של דבר, חלבונים. כאשר חומצות האמינו נמצאות בסדר שגוי מתרחשות "שגיאות איות" (או תרגום שגוי), לעיתים קרובות עם תוצאות מצערות עבור הבריאות של בעל-החיים.
באופן רגיל, פרודות ר.נ.א. קטנות, הקרויות ר.נ.א. שליח (transfer RNAs, tRNAs), מעבירות חומצות אמינו מוגדרות לריבוזומים, אותם "המפעלים" התאיים לבניית חלבונים, כך שחומצות האמינו יתווספו במיקום הנכון לשרשרת החלבון הצומחת מתוך הריבוזום. בתחילת תהליך זה, עשרים אנזימי tRNA, כל אחד מתאים במדויק לעשרים חומצות האמינו הנפוצות, "קושרים" את החומצה המתאימה הנדרשת להעברה ומחברים את החומצות יחדיו.
אולם, כפי שמסביר אחד מכותבי המאמר, "לעיתים מתרחשות שגיאות. במיקומים בהם אמורה להימצא חומצת האמינו אלאנין, מופיעה בטעות החומצה סרין או גליצין במקום."
בשנת 2006 הראו החוקרים את ההשלכות של שגיאה מסוימת זו בבניית חלבונים של זן עכברים שעברו מוטציה מכוונת. כאשר האנזים המצרף את חומצת האמינו אלאנין ל- tRNAs, המכונה "אלאניל-tRNA-סינתאטאז" (AlaRS) – ממקם בטעות את מטענו, השגיאה מובילה להצטברות של חלבונים שהתקפלו באופן שגוי, ולעכבר נגרמים ליקויים נוירולוגיים קשים. מחקר נוסף של אותה קבוצת המדענים הראה כי החיידק אשריכיה קולי בעל אותה המוטציה הופך לרגיש ביותר לחומצות האמינו סרין וגליצין ופשוט מת כאשר אלו (ולא אחרות) מוספות לתרבית הגידול. מובן מאליו, כי הטבע השקיע מאמץ רב למנוע שגיאות חמורות שכאלו.
החוקרים הראו כי "הטבע" מתנהל בזהירות מרובה בכל הקשור לבקרת האיכות של אלאנין בייצור חלבונים. האנזים המתאים (AlaRS) לא רק מטעין ומעביר את חומצת האמינו אלאנין, אלא מוודא גם שהיא מתחברת לחומצה המתאימה לה. בנוסף, יצורים רבים, החל מחיידקים וכלה באדם, מכילים גם פרודה חופשייה ביותר המשמשת כ"בודקת איות" (spellchecker) – בצורת חלבון המכונה AlaXp – ומוודאת כי אלאנין ממוקמת במקום הנכון.
"פעולת העריכה נראית מיותרת," אומר החוקר הראשי. "הממצא מוביל למספר תהיות: מדוע התאים כה רגישים לשגיאות אלאנין במיוחד? מדוע החלבון המתקן AlaXps התפתח כה מוקדם? ומדוע עדיין קיימים חלבונים הנראים כמיותרים ובלתי שמישים?"
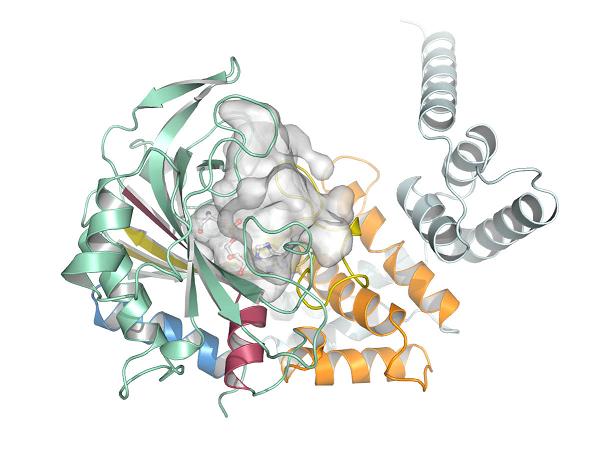
במחקרם החדש, המדענים השתמשו במגוון שיטות מדידה, בכללן קריסטלוגרפיית קרני-רנטגן, ואנליזת מוטציות קינטית בכדי לענות על תהיות אלו.
הממצאים מראים כי אחת הסיבות שבגינן האנזים AlaRS מתקשה להבחין בין אלאנין לבין סרין וגליצין הינה שהאתר הפעיל שלו הינו נישה גמישה ורחבה. במקום לשמש כ"מנעול" קשיח עבור "מפתח" ייחודי, המתחם הפעיל מתנועע כדי שיוכל לחבור לא רק לחומצת המטרה שלו – אלאנין – אלא גם לחומצות בעלות גודל דומה, סרין וגליצין.
אולם, סרין וגליצין אינן בעלות גודל זהה לזה של אלאנין. כאן מגיע לו "פרדוקס הסרין". גליצין קטנה מאלאנין ואילו סרין גדולה ממנה. תיאוריות קיימות לא תחזינה כי פרודות שהינן גם גדולות וגם קטנות מאלאנין תהוונה בעיה לאנזים AlaRS.
"הסיבה שאנו מכנים זאת פרדוקס הינה שלאף אחד מאנזימי הסינתטאז האחרים של tRNA ישנה בעיה של הפעלה שגויה הן של חומצת אמינו גדולה יותר והן של חומצה קטנה יותר," מסביר החוקר הראשי. "תיאורטית, לאנזימים מסוג זה אמורה להיות בעיה של הכרת חומצות אמינו קטנות יותר מהיעד, מכיוון שפרודות קטנות יותר מסוגלות גם הן לחדור לאתר הפעיל. קל להסביר זאת עבור חומצה קטנה יותר. הבעיה מתחילה עם ההסבר לחומצה נפחית יותר."
באופן בלתי-צפוי, ממצאי המחקר החדש חשפו גם כי בתוככי האתר הפעיל של האנזים AlaRS הקבוצה החומצית Asp235 יוצרת קשר מימני נוסף עם פרודת הסרין הנפחית יותר. מתברר כי קשר נוסף זה הינו הכוח העיקרי המסייע להחזיק את חומצת הסרין ("השגויה") בחלל האנזים, חרף גודלה הרב יותר.
אולם, מדידה באמצעות קריסטלוגרפיית קרני-רנטגן הראתה כי הקבוצה Asp235 הינה חיונית גם עבור הקשירה של חומצת האמינו אלאנין. ניסיונות להחליף את הקבוצה החומצית Asp235 בקבוצות אחרות כשלו. למעשה, החוקרים גילו כי כל שינוי שיעלים את הקישור השגוי עם הסרין בהכרח גם ישפיע שלילית על הקישור עם החומצה המתאימה, אלאנין. בשל כך, הטבע פיתח פיתרון נוסף באמצעות הייצור של AlaXp, שתוכנן במיוחד לבצע בדיקת איות נוספת שתימנע כל חיבור שגוי של החומצה אלאנין.
השילוב של אתר פעיל רחב וגמיש והקשר המימני הנוסף עם סרין מסביר את הבסיס הכימי של בלבול שכיח בין גליצין וסרין לבין אלאנין, וכן את הצורך בבדיקות נוספות כדי לאמת כי אלאנין, ולא החומצות הדומות לו, ימוקם כהלכה ברצף שיוליד, בסופו של דבר, את החלבון הנדרש.
"כעת אנו מסוגלים להבין מדוע הטבע התאמץ לפתח שני מנגנוני בדיקה נפרדים," מסביר החוקר הראשי. "זה מה שנדרש בכדי לקבל רצף נכון של חומצות אמינו בחלבון. בעיניי, מפתיע שמאפיין כימי יחיד יכול לקבוע את הגורל של כמעט כל אורגניזם בכדור-הארץ. יצורים, החל מחיידקים וכלה בבני-אדם חולקים את אותו הפיתרון הביולוגי שהטבע מצא לבעיה כימית קריטית זו."