נפגשתי עם ענבל צרפתי-ברעד כדי לשאול אותה מה עושים שם באוניברסיטה.
נפגשתי עם ענבל צרפתי-ברעד כדי לשאול אותה מה עושים שם באוניברסיטה.
ענבל היא דוקטורנטית במחלקה להנדסת ביוטכנולוגיה באוניברסיטת בן-גוריון שבנגב. היא עובדת במעבדה לננו-ביוטכנולוגיה של דר' לוי גֶבֶּר. היא נשואה וגרה בבאר-שבע עם בעלה, איש הייטק. ענבל אוהבת מאוד ללמד באוניברסיטה, ובזמנה הפנוי משחקת ברידג'.
ענבל, אז מה אתם עושים שם?
המחקר במעבדה מתפרש על מגוון תחומים שקשורים לשימוש בחומרים ביולוגיים בסקלה ננומטרית, וכולל שימוש בטכניקות מיקרוסקופיה מתקדמות. אחד התחומים העיקריים במעבדה הוא המחקר של ביוסנסורים, כלומר חיישנים ביולוגיים. המחקר שלי עוסק במערכי נוגדנים (immunoarray) המשמשים לגילוי חומרים ואבחון רפואי נייד.
טוב, נלך לפי הסדר, מהם ביוסנסורים?
ביוסנסורים משמשים לבדיקה של המצאות חומר מסוים בתמיסה. החומר יכול להיות למשל רעל, חיידק או חלבון כלשהוא, והתמיסה יכולה להיות למשל מים, דם וכדומה. מכאן שביוסנסורים יכולים לשמש לבדיקת רעילות של מים, לאבחון של מחלה, לבדיקת רמת הסוכר בדם ולדברים נוספים.
אחד הכלים היעילים למימוש של ביוסנסור הם נוגדנים.
מהם נוגדנים, ואיך הם קשורים לאבחון רפואי?
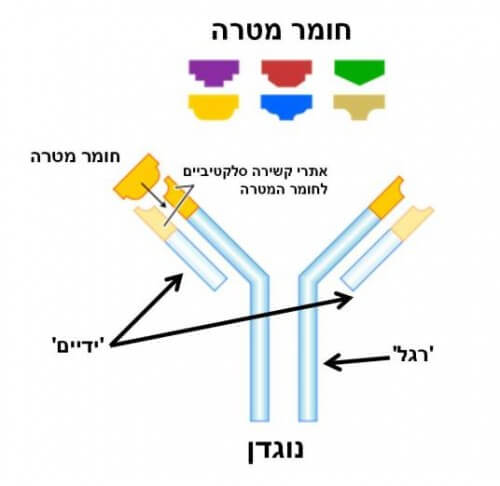
הנוגדן הוא חייל של מערכת החיסון שלנו, והוא מצויד בשתי ידיים ורגל אחת (ראו איור 1). שתי הידיים של הנוגדן 'יודעות' לתפוס אך ורק חומר מסוים, כלומר מותאמות להיקשר כימית לחומר זה בצורה סלקטיבית כמו מפתח ייחודי הפותח מנעול. לאחר שהנוגדן נקשר לחומר שאליו הוא מותאם, הרגל שלו מסמנת לשאר המערכת החיסונית שזוהה חומר חשוד, ושיש לפעול בהתאם.
בתחום האבחון הרפואי אנחנו מנצלים את יכולת הקשירה הסלקטיבית של הנוגדן למטרות זיהוי וסימון. למשל, כדי לבדוק הימצאות של חומר מסוים בתמיסה אפשר להשתמש בנוגדנים שאליהם מוצמדים סמנים פלואורסנטים, כמו נורות קטנות שמפיצות אור, שאותן ניתן לגלות בעזרת מיקרוסקופ מתאים. הנוגדנים ייקשרו אך ורק לחומר המטרה, וכך נוכל להשתמש במיקרוסקופ כדי לבדוק האם אותו חומר קיים בתמיסה, ואולי אף להעריך את הכמות.
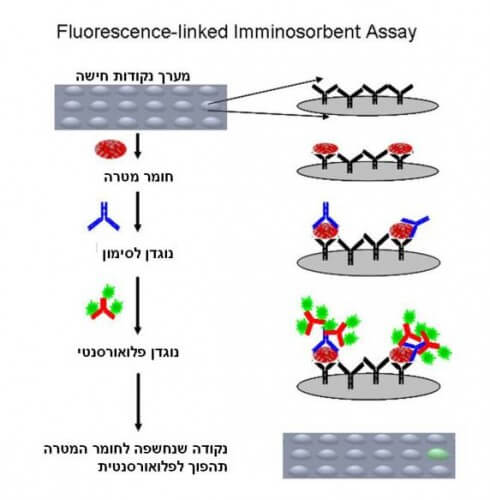
אחת הדרכים הנפוצות והיעילות להשתמש בנוגדנים לאבחון היא בעזרת משטחים מיוחדים שמכונים microarrays, מיקרו-מערכים של נקודות קשירה, והם נמצאים בשימוש כבר היום, לדוגמא בבדיקות דם שאנו עושים אצל הרופא. ישנן מספר דרכים להשתמש במערכים ובנוגדנים למטרת אבחון רפואי (ראו איור 2), אבל המשותף לכולם הוא שנוגדנים מסומנים יקשרו אך ורק לחומר המטרה. בסוף התהליך ניתן לגלות את הסמנים הפלואורסנטיים (ולכן גם את חומר המטרה) בעזרת מיקרוסקופ מתאים.
עד עכשיו הכול נשמע מצוין, אז היכן הבעיה?
או, אני שמחה שאתה שואל. מי שעבר בדיקת דם ודאי זוכר שלתוצאות יש להמתין לפחות כמה ימים. אחד הגורמים לכך הוא גודל נקודה על פני המערכים. אותם מערכים שנמצאים בשימוש כיום מכילים נקודות שגודלן נע סביב 150 מיקרומטר (מיקרומטר=10-6 מטר, כאשר קוטר שערה הוא בערך כמה עשרות מיקרומטר). המשמעות היא שרק מספר נמוך של נקודות נכנס בשדה הראיה של המיקרוסקופ ברגע נתון. כלומר סריקה של מערך מלא לוקחת זמן רב, ומבוצעת על ידי מכונות במעבדות גדולות.
השאיפה היא לייצר גרסה של שיטת האבחון שהיא מהירה וזולה יותר ושאינה זקוקה למכונות גדולות ולכן גם ניידת, כך שניתן להשתמש בה על ידי הפעלה של מכשיר קטן בחדר הרופא.
אז מה הפתרון?
אחד הכיוונים העיקריים שנבדקים הוא הקטנת גודלן של הנקודות על גבי המערך לקוטר של מיקרומטר ומטה. בצורה זאת ניתן לראות אלפי נקודות בשדה הראיה של המיקרוסקופ, ואין צורך בסריקת המערך. כמו כן פיתוח זה יאפשר את מזעורו של ציוד הבדיקה לגודלו של טלפון סלולרי ממוצע.
יתרון נוסף הנובע מהמזעור הוא החיסכון בכמות הנוגדנים הנדרשת. מכיוון שעלות הנוגדנים גבוהה מאוד, דבר זה עשוי להוביל גם להוזלה בעלות הבדיקה.
עד עכשיו הכול נשמע מצוין, אז היכן הבעיה?
או, אני שמחה שאתה שואל. למזעור הנקודה על פני מערך האבחון יש תופעת לוואי לא רצויה. ככל שהנקודה קטנה יותר, כך עוצמת האור שהיא פולטת חלשה יותר. על שטח קטן נתפסים פחות נוגדנים ולכן פחות מאותן נורות פלואורסנטיות.
אותנו מעניין להבין את המגבלות של מערכת האבחון כתלות בגודל הנקודות. כמה ניתן להקטין את הנקודות ועדיין לשמר את היכולת להבחין בהן במיקרוסקופ, ובמה תלויות מגבלות המערכת?
מאיפה מתחילים?
אחת המגבלות הידועות נובעת מהמיקרוסקופ עצמו. גבול הרזולוציה של כל המיקרוסקופים המבוססים על אור הוא 200-400 ננומטר (ננומטר=10-9 מטר, סדר גודל של וירוס למשל) ולכן לא ניתן למדוד גדלים קטנים יותר. כלומר, גם אם נצליח לייצר נקודה בגודל כמה ננומטרים שמאירה חזק מאוד, היא תראה במיקרוסקופ בגודל של כמה מאות ננומטרים.
מגבלה חשובה נוספת שמצאנו נובעת מצפיפות אתרי הקשירה ועוצמת ההארה.
מהי צפיפות אתרי הקשירה?
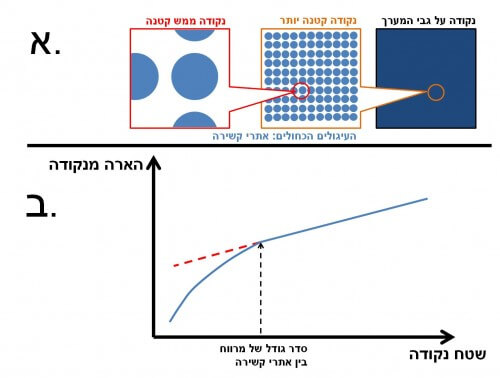
דמיינו שאתם מביטים על דשא ממעוף הציפור. מה שאתם רואים הוא פשוט משטח ירוק. אך ממבט קרוב יותר תבחינו שבעצם עלי הדשא פזורים על פני האדמה ואינם צמודים אחד לשני. גם המולקולות הביולוגיות הקשורות על פני המשטח של נקודה על מערך האבחון מפוזרות בצפיפות מסוימת (ראו איור 3א). כל עוד הנקודה גדולה, ההארה פרופורציונית לשטח. כאשר הנקודה היא מסדר גודל של המרחק הממוצע בין אתרי הקשירה עוצמת ההארה יורדת חזק, וכבר אינה פרופורציונית לשטח (ראו איור 3ב). לכן, בשימוש בנקודות קטנות יש צורך בצפיפות גבוהה של אתרי קשירה.
כדי לבדוק את הטענה, בנינו סדרת מערכים עם נקודות בגדלים שונים, והראנו את ההשפעה המכרעת בנקודות קטנות. המסקנה היא שהקטנה של הנקודות במערך, ללא התחשבות בצפיפות אתרי הקשירה, לא תוביל לשיפור אלא פעמים רבות תוביל דווקא לירידה באיכות הגלאי עקב שונות גדולה בעוצמת ההארה של הנקודות.
אז האם ניתן להקטין את הנקודות לגודל של מיקרון בודד?
במהלך המחקר הראנו שזה אפשרי. עבור מערכים מסוימים שחקרנו הצלחנו לזהות את חומר המטרה אפילו בעזרת נקודות בגודל 300 ננומטר! הבעיה היא שלא הצלחנו להגיע לתחום רחב מספיק של עוצמת ההארה כך שנוכל גם לכמת את התוצאה, כלומר להחזיר תשובה שאינה רק 'כן' או 'לא', אלא גם כמותית, כלומר 'כמה'.
כדי להגיע ליכולת הזאת אנחנו צריכים להגדיל את עוצמת ההארה של נקודה בודדת, ולכן בימים אלה אנחנו בוחנים מספר אפשריות להשגת המטרה. כפי שכבר ציינתי, החזון שלנו הוא לקדם, בין היתר, את פיתוח האבחון הרפואי הנייד, שבעקבותיו יוכלו בדיקות רפואיות מסוימות להתבצע במהירות וביעילות כבר בחדר הרופא.
————————————————-
אני אשמח להפגש ולשוחח עם כל תלמיד מחקר (אולי אתם?) שמוכן להשתתף ולספר לי קצת על מה הוא עושה (והכול במחיר של שיחה לא יותר מידי ארוכה). תוכלו ליצור איתי קשר דרך טופס יצירת קשר.
זה הזמן לספר לכולם מה אתם עושים, אולי הפעם הם גם יבינו
המאמר פורסם בבלוג של אורן שעיה "עד כדי קבוע"
