איך בית החרושת לחלבונים מצמיד מולקולות של חומצות אמיניות ויוצר מהן חלבונים

כל גננת יודעת ללמד את ילדי הגן כיצד להשחיל חרוזים על חוט וליצור מחרוזת. אבל בדרך זו נוצרת מחרוזת אקראית, או על-פי העדפותיו של חורז המחרוזת. לעומת זאת, מולקולת חלבון, הבנויה כמעין מחרוזת של "חרוזים" שהם מולקולות של חומצות אמינו, נוצרת בריבוזום, בית החרושת לחלבונים של התא, על-פי תוכנית סדורה המוכתבת על-ידי הצופן הגנטי. אבל כיצד בדיוק הריבוזום מצרף את חומצות האמינו זו לזו ויוצר את ה"מחרוזת" החלבונית? כיצד הוא יוצר ביניהן את הקשר הפפטידי? שאלה זו עמדה פתוחה במשך שנים רבות, ועדיין אינה ברורה לחלוטין, אך באחרונה נעשו כמה צעדים משמעותיים לקראת פתרון התעלומה. להישג זה אחראים פרופ' עדה יונת וחברי קבוצת המחקר שלה מהמחלקה לביולוגיה מבנית במכון ויצמן למדע, שעבדו בשיתוף עם פרופ' לואיס מסא מאוניברסיטת המדינה של ניו-יורק, וג'רום קרלה, חתן פרס נובל לפיסיקה לשנת 1985 ממכוני המחקר של הצי האמריקאי.
במחקרים קודמים הצליחה פרופ' יונת לפענח את המבנה המרחבי, התלת-ממדי, של הריבוזום, שהוא מבנה המכיל מספר חלבונים, ולהבהיר את עקרונות פעולתו.
בעבודה זו, שבוצעה בעבר ונמשכה יותר מ-20 שנה, השתתפו גם מדעני מכון מקס פלנק בגרמניה. לצורך פיענוח מבנה הריבוזום השתמשו המדענים בטכנולוגיה הקרויה קריסטלוגרפיה בקרני X (רנטגן). בשלב הראשון של השיטה הזאת יש ליצור גבישים מהחלבון, או מהחלקיק הנחקר. את הגבישים האלה מקרינים בקרני X, ולאחר מכן מודדים את הקרינה המתפזרת מהגביש, מעבדים את הנתונים, וממפים את התפלגות צפיפות החומר הנמדד במרחב. מידע זה מלמד את המדענים על המבנה המרחבי של המולקולות המרכיבות את הגביש.
כך עלה בידיהם של פרופ' יונת וחברי קבוצת המחקר שהיא עומדת בראשה, לפענח את מבנה הריבוזום, ולאחר מכן גם "לצלם" את יחידות המשנה שלו, הקרויות S30 ו-S50 בתצורותיהן הפעילות. כך הצליחו חברי קבוצת המחקר של פרופ' יונת "לראות" את יחידת המשנה הקטנה, בשלב שבו נוצר המגע הראשון בין מולקולת האר-אן-אי שליח לבין הריבוזום. מגע זה מאותת על האפשרות להתחלת תהליך ייצורו של חלבון על-פי המידע הגנטי הנישא במולקולת האר-אן-אי שליח. כך, למעשה, הריבוזום קורא את המחרוזת המולקולרית של האר-אן-אי שליח, ועל-פי המידע הצפון בה יוצר מחרוזת מולקולרית חלבונית, הבנויה מחומצות אמינו בתהליך כימי אשר מבוצע ביחידת המשנה הגדולה של הריבוזום.
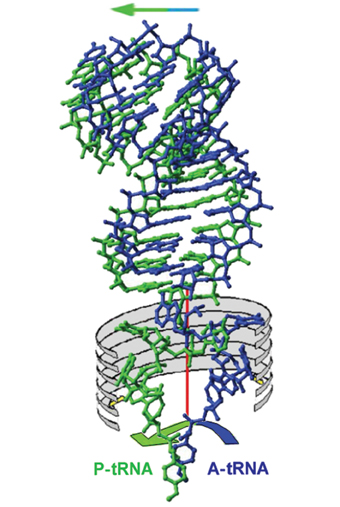
בתהליך יצירת החלבון בריבוזום מעורבות "משאיות" מולקולריות הקרויות טי-אר-אן-אי, המביאות את המולקולות של החומצות האמיניות אל הריבוזום. למעשה, לכל חומצה אמינית יש "משאית" ייחודית לה, היודעת לקרוא את הקידוד שלה בלבד, ונושאת רק אותה. על-אף הייחוד התפקודי הזה, מתברר שבבסיסו של דבר, כל ה"משאיות" הן בעלות מבנה דומה. המדענים אהרון קלוג, חתן פרס נובל בכימיה לשנת 1982, ואלכסנדר ריץ' (שניהם חברי מועצת המנהלים של מכון ויצמן למדע), שהתמקדו במבנה המרחבי התלת-ממדי של הטי-אר-אן-אי, גילו את מבנה ה"משאיות" כפי שהן נראות כשאינן קשורות לריבוזום: הן בנויות ברובן מגדיל כפול של אר-אן-אי, אבל שני הקצוות בעלי התכונות הייחודיות והתפקוד הכימי-ביולוגי עשויים משרשרת חד-גדילית בעלת גמישות רבה.
ה"משאית" הנבחרת על-פי הקידוד שבצופן הגנטי נקשרת מצד אחד למולקולת האר-אן-אי שליח, ומאחר שהיא נושאת את החומצה האמינית המתאימה, היא למעשה מובילה את מולקולת החומצה האמינית אל השרשרת של החלבון המתהווה. כש"משאית" אחת כזאת ממלאת את תפקידה, היא מפנה את מקומה ל"משאית" נוספת, הנושאת חומצה אמינית נוספת, וכך חוזר התהליך עד להשלמתה של המחרוזת החלבונית.
כפי שגילו קלוג וריץ', ה"משאית" (הטי-אר-אן-אי) מורכבת משני חלקים, חלק אחד שהמבנה שלו יכול להשתנות בקלות יחסית, ואילו החלק האחר בעל מבנה יותר קבוע. החלק הקבוע כולל מעין "תפס" שמחזיק את מולקולת החומצה האמינית. פרופ' יונת וחברי קבוצת המחקר שלה הראו, כי בתהליך יצירת הקשר הפפטידי, חלק אחד של הטי-אר-אן-אי זז קדימה יחד עם מולקולת האר-אן-אי שליח (כדי לקדם את הצופן הגנטי), ואילו החלק השני (כלומר גדיל האר-אן-אי הבודד) מסתובב, כשנקודת הקשר בין החלק הקבוע וגדיל האר-אן-אי הבודד משמשת כציר. כך, בכל סיבוב, החלק המסתובב של ה"משאית" מביא אל החלבון שנוצר חומצה אמינית נוספת. תנועת הסיבוב מתאפשרת מכיוון ששני האתרים בריבוזום שאליהם נקשרת היחידה הנעה של הטי-אר-אן-אי הם סימטריים, ובדרך זו תוואי התנועה הסיבובית מוכתב ונתמך על-ידי המסגרת שהיא אבן הפינה של מבנה הריבוזום.
המבנה המרחבי התלת-ממדי של יחידת הטי-אר-אן-אי החופשי ידוע זה שני עשורים. אולם השינויים שחלים בו בעת הקישור לריבוזום עדיין נלמדים. הקושי בפיענוח התעלומה נובע מהעובדה, שמיד עם הקישור שלו לאר-אן-אי שליח (מצד אחד) ולחומצה האמינית (מצד שני) הוא מתחיל לנוע ולפעול במהירות רבה מאוד. מהירות זו מקשה על המדענים שמנסים "להקפיא" את היחידה במצבים מסוימים ולפענח את מבניהם. חברי קבוצת המחקר של פרופ' יונת השתמשו במולקולות המדמות אותו, ובדרך זו הצליחו לפענח את מבנה יחידת הטי-אר-אן-אי המובילה את החומצה האמינית כשהיא קשורה למחצית האתר הפעיל של ה"משאית". לאחר שגילו את הסימטריה הגורמת לתנועה הסיבובית, הצליחו המדענים לחשב את מיקום יחידת הטי-אר-אן-אי השנייה. תגלית זו קידמה במידה משמעותית את מסע המחקר לפיענוח מסתרי הקשר הפפטידי, אבל עדיין לא היה ברור מתי והיכן מתחוללת הבנייה של המחרוזת החלבונית. כלומר, האם החומצות האמיניות מוצמדות לשרשרת החלבונית המתהווה לפני, אחרי, או תוך כדי הסיבוב.
כדי לענות על השאלה הזאת שיתפה פרופ' יונת פעולה עם המדענים לואיס מסא מאוניברסיטת המדינה של ניו-יורק, וג'רום קרלה, חתן פרס נובל לפיסיקה לשנת 1985 ממכוני המחקר של הצי האמריקאי. יחד, הם הפעילו שיטה הקרויה "קריסטלוגרפיה קוואנטית", המבוססת על חישוב מערכת היחסים הקוונטית בין האטומים המרכיבים את היחידה הנחקרת. בפועל, הם התמקדו ב-50 אטומים המוקמים סביב האיזור ביחידת הטי-אר-אן-אי המבצע את הקשר הפפטידי, וחישבו כיצד האטומים האלה יתארגנו במרחב אם יינתן להם חופש מוחלט. בתנאים כאלה, המבנה שהאטומים "יעדיפו" הוא המבנה שאחזקתו תחייב הוצאה של כמות האנרגיה הקטנה ביותר. כך עלה בידם "לתפוס" את הטי-אר-אן-אי במצב ביניים במהלך הסיבוב. חישוב נוסף הראה, שהאנרגיה הדרושה לתהליך מופקת, בנוסף לאנרגיה ה"מוקצבת" לשינוע תנועת התקדמת הצופן הגנטי בכללותו, גם מהיווצרות ושבירה של קשרים כימיים בין האיזור המסתובב והמסגרת של הריבוזום בתהליך הסיבוב. ממצאי המחקר הזה פורסמו באחרונה בכתב העת המדעי "רשומות האקדמיה למדעים של ארצות-הברית", PNAS.
 פרופ' יונת: "תרופות אנטיביוטיות מסוימות פוגעות בחיידקים כשהן נצמדות למקום הקישור של יחידת הטי-אר-אן-אי בריבוזומים שלהם, משתקות אותם, ומונעות בכך היווצרות של חלבונים חדשים החיוניים לחיידק. ההבנה שהשגנו באשר לדרך בנייתו של חלבון בריבוזום תאפשר פיתוח של תרופות אנטיביוטיות יעילות יותר, שיוכלו לפגוע גם בחיידקים שכבר פיתחו עמידות כנגד תרופות אנטיביוטיות קיימות".
פרופ' יונת: "תרופות אנטיביוטיות מסוימות פוגעות בחיידקים כשהן נצמדות למקום הקישור של יחידת הטי-אר-אן-אי בריבוזומים שלהם, משתקות אותם, ומונעות בכך היווצרות של חלבונים חדשים החיוניים לחיידק. ההבנה שהשגנו באשר לדרך בנייתו של חלבון בריבוזום תאפשר פיתוח של תרופות אנטיביוטיות יעילות יותר, שיוכלו לפגוע גם בחיידקים שכבר פיתחו עמידות כנגד תרופות אנטיביוטיות קיימות".
בתהליך הסיבוב. ממצאי המחקר הזה פורסמו באחרונה בכתב העת המדעי "רשומות האקדמיה למדעים של ארצות-הברית", PNAS.

6 תגובות
אני לא הייתי מתיחסת לזה אבל עכשיו אני יתיחס לזה הרבה יותר.
תודה רבה!
את צודקת במאה אחוז גם אני גננת וגם אני חושבת כך.