החוקרים, בראשותו של פרופ' דן פאר מאוניברסיטת ת"א התמקדו במחלות מעיים דלקתיות כרוניות, ופיתחו נשא ננומטרי ממוקד-מטרה המוביל לתאים החולים חומר גנטי (mRNA) שגורם לייצור חלבונים משככי דלקת לדברי החוקרים, הפלטפורמה תהיה יעילה גם בשורה של מחלות קשות כדוגמת: סרטן, דלקתיות כרוניות, מחלות גנטיות נדירות ועוד. פרופ' פאר: מקווים שבתוך שנים אחדות היא תהיה זמינה גם לטיפול בבני אדם." המאמר מתפרסם היום (ב'( בכתב העת Nature Communications
חוקרים במעבדתו של פרופ' דן פאר, ראש המרכז לחקר הביולוגיה של הסרטן באוניברסיטת תל אביב, הצליחו לפתח פלטפורמה לשיגור של חומרים גנטיים המעודדים ייצור של חלבונים ספציפיים הנלחמים בתאי המטרה החולים.
הפלטפורמה החדשנית, המתאימה למגוון רחב של מחלות (כולל סרטן, דלקות כרוניות ומחלות גנטיות נדירות), מאפשרת טיפול גנטי מדויק בתאים החולים, ללא השפעה על תאים בריאים, או במילים אחרות, ללא תופעות לוואי – שעלולות לעתים לגרום יותר נזק מהמחלה עצמה.
המחקר פורץ הדרך, שהתמקד בדלקות מעיים אוטואימוניות כרוניות, כמו קרוהן וקוליטיס, בוצע בהובלת הדוקטורנטית נופר וייגה, ובסיוע חוקרים נוספים במעבדתו של פרופ' פאר. המאמר מתפרסם היום (ב') בכתב העת Nature Communications .
"טיפול גנטי הוא טכנולוגיה רפואית חדשנית, הנעזרת בחומר גנטי כדי לעורר בגוף ייצור של חלבונים שנלחמים במחלה, או לחלופין, לדכא ייצור של חלבונים שתומכים בה," מסבירה נופר וייגה. "האתגר המרכזי, שלא נמצא לו מענה עד היום, הוא להביא את החומר הגנטי באופן מדויק וספציפי – אך ורק לתאי היעד החולים, שכן, אם יגיע גם לתאים בריאים בסביבה, הוא
עלול לגרום לתופעות לוואי חמורות. במעבדה שלנו אנחנו עוסקים כבר זמן מה בפיתוח פלטפורמה חדשה וספציפית ביותר, שתיתן מענה לבעיה."

הנוגדנים שימשו כנווטים אל היעד
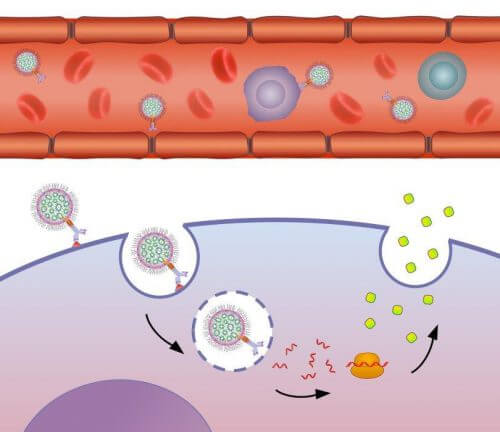
לצורך עבודתם נעזרו החוקרים במודלים של עכברים עם מחלות מעיים אוטואימוניות כרוניות, הנגרמות בשל פעילות דלקתית מוגברת של תאים במערכת החיסון המכונים Ly6c. כדי למתן ולכוונן את פעילותם של תאי מערכת החיסון שיצאו משליטה, ביקשו החוקרים לשגר אליהם חומר גנטי מסוג mRNA (messenger RNA), שיעורר בהם ייצור של חלבון אנטי-דלקתי בשם אינטרלוקין 10 (IL10).
כדי לשגר במדויק מולקולות mRNA לקידוד IL10, כך שיגיעו ספציפית לתאי Ly6c בלבד, ויפעלו בהם את פעולתם, השתמשו החוקרים בנשאים חדשניים: מולקולת ה-mRNA המתאימה נארזת בתוך חלקיקים ננומטריים מבוססי מולקולות שומן, המקושרים לנוגדנים ספציפיים ל-Ly6c, שמתבייתים על היעד בדיוק רב.
מסבירה נופר וייגה: "יתרונם הגדול של נוגדנים כנווטים לנשאים הזעירים, הינו הספציפיות הגבוהה שלהם. נוגדן הוא חלבון המיוצר על ידי מערכת החיסון במטרה לזהות מולקולה אחת מסוימת, ורק עליה הוא מתביית. במערכת שלנו מחוברים הנוגדנים לחלקיקים נושאי המטען באמצעות חלבון מתווך שפיתחנו במחקר קודם." במסגרת המחקר החדש הוחדרו הנשאים הזעירים לגופם של העכברים החולים, והתוצאות היו מבטיחות: התסמינים הקשים של מחלות המעיים הדלקתיות פחתו במידה משמעותית.
"הפלטפורמה שפיתחנו מתאימה לטיפול גנטי במגוון גדול מאוד של מחלות – מסרטן ועד מחלות דלקתיות ואוטואימוניות ומחלות גנטיות נדירות – ובכך חשיבותה," מסכם פרופ' פאר. "באמצעותה ניתן לשגר כל חומר גנטי לכל תא בגוף, על פי בחירתנו, ובדרך זו לעכב או לעודד ייצור של חלבונים נבחרים המשפיעים על מהלך המחלה. למעשה, המחקר הנוכחי מהווה מחקר המשך לעבודות קודמות, בהן שיגרנו לתאים החולים חומר גנטי מסוג siRNA (silencing RNA), שמשתיק את ביטוים של גנים התומכים במחלה. במחקר שפורסם בקיץ האחרון טיפלנו בדרך זו בהצלחה בעכברים עם סרטן קשרי הלימפה (לימפומה). כיום אנחנו ממשיכים לחקור ולפתח את השיטה ואת שימושיה, ומקווים שבתוך שנים אחדות היא תהיה זמינה גם לטיפול בבני אדם."

5 תגובות
למה כל כך הרבה שנים צריך לחכות מחלקות מלאות בחולים שמתים יום יום.
במה זה תלוי בחוסר תקציב בחוסר כ"א למה לא שומעים את הביולוגים בארץ מה קורה ולמה התרופות לא מקודמות כמו הקידמה הגיע הזמן לעורר את הקהל אם חסר משהוא נעשה הכל כדי להרים את הכפפה.
ולעזור לאנשים חסרי ישע ומזור.
איך ולמה נכנס אותו נשא לתוך התא לאחר שנקשר לאנטיגן על התא ?
זה יהיה מוכן לשימוש ב-2045 . כאשר כל ילד ידע להכין תרופה בעצמו בבית .
אתר עושים עבודת קודש ומצילים חיים! אלופים, המשיכו בכל הכח!!
תודה!