גישה ניסויית חדשה המשלבת כימיה וביולוגיה מאפשרת למדענים להציץ אל מעמקי השליט העליון של הגוף

מאת קרל דיסרות', הכתבה מתפרסמת באישור סיינטיפיק אמריקן ישראל ורשת אורט ישראל 08.12.2016
- מנגנוני הפעולה של המוח יתגלו למדענים רק באמצעות חקירה מדוקדקת של תאים יחידים בשילוב סקירה בקנה מידה גדול של האיבר השלם.
- שיטות שגרתיות להדמיה אופטית אינן מצליחות לחדור לעומק רקמת המוח בגלל פיזור האור במגע עם מים ובגלל מולקולות השומן בקרומי התאים.
- שיטות חדשות המסלקות את השומנים ומחליפות אותם בחומר שמחזיק במקומם את חלקי המוח מספקות חלון הצצה אל מעבר למחסומים הטיפוסיים המונעים מאתנו לראות את תוככי המוח.
- שיטות המקבעות את הרקמה בהידרוג'ל, כפי ששיטות אלו קרויות, מאפשרות לחוקרים לבחון את החיווט של מעגלים עצביים ספציפיים השולטים בהתנהגויות שונות.
מערכת העצבים שלנו היא כעין שטיח קיר, מארג חוטים סבוך. חוטים אלו, סיבים דקים הקרויים אַקסונים, נמשכים מתאי העצב ונושאים מידע חשמלי אל תאי עצב אחרים המגיבים לאותות. אקסונים הנשלחים למרחקים ארוכים, כמו חוטי השתי באריג, שזורים ב"חוטי הערב" של המוח: אקסונים המתפתלים הלוך ושוב למרחקים קצרים ומעבירים אותות כדי לבצע חישובים.
כדי להבין את מנגנוני הפעולה הפנימיים של המוח, מדענים צריכים לפענח כיצד מאורגן האריג העצבי הזה ברמת המרכיבים היחידים, כמו למשל אקסונים יחידים. אבל כדי להבין את התפקיד שממלא אקסון, היינו רוצים גם שתהיה לנו נקודת מבט כללית על המוח כולו, בלי להתעלם מן האקסון היחיד הדק ומן ההקשרים שלו. אבל המוח אינו שטוח כמו אריג, וגם אינו שקוף, ולכן, כדי להשיג נקודת מבט כזאת, יש צורך בכלי מיוחד. ואולם, המוח אטום לאור: מולקולות שומן (ליפידים) המצויות בכל רחבי המוח, בייחוד בקרומי התאים, מפזרות את האור הנשלח ממכשירי ההדמיה ופוגמות במידה ניכרת ביכולת שלנו להסתכל מעבר לשכבה החיצונית והדקה ביותר של המוח אל תוך מעמקיו.
כעת, טכנולוגיה חדשה חשפה אופקים חדשים ומרגשים למדעני המוח, ויצרה דרך להסתכל גם על המוח השלם כדי לראות בו מסלולים עצביים וגם להגדיר תכונות מולקולריות של סיבי עצב יחידים המשתרגים בתוככי המוח. השיטה הזאת מבוססת על כימיה של ג'לים מבוססי־מים, או הידרוג'לים, שהם פולימרים שיוצרים רשת תלת־ממדית של אזורים הקשורים זה לזה ומסוגלים להכיל מים בלי להתמוסס. השיטה משמשת לייצור פיגומים פנימיים תלת־ממדיים בתוך רקמות ביולוגיות. בתהליך תלת־שלבי זה, מכינים תחילה ג'ל שקוף במוחות של חיות מעבדה או של בני אדם לאחר המוות. הג'ל נקשר ומגן על החלקים המולקולריים עתירי המידע של המוח, ובכללם חלבונים וחומצות גרעין (דנ"א ורנ"א). לאחר שלב זה, מסירים את מרכיבי הרקמה שאינם מעניינים או שידועים כמפזרי אור, כמו שומנים. ולבסוף, מחדירים לכל מבנה המוח סמנים פלואורסצנטיים או סמנים אחרים. החדרת הסמנים מתאפשרת משום שהג'ל אינו רק שקוף אלא גם מתוכנן לאפשר החדרה מהירה של חומרים נוספים. לאחר זאת, מדענים יכולים להאיר את המוח דרך ההידרוג'ל השקוף, לגרום לסמנים לזהור, ולראות באופן ישיר מולקולות וסיבים מעניינים ברזולוציה גבוהה מאוד בכל רחבי המוח השלם.
יכולת חדשה זו להביט במעמקי השליט העליון של הגוף מוליכה לתובנות רבות. מדענים משתמשים בגישה החדשה כדי לקשר בין צורה פיזית ובין תפקוד התנהגותי של מסלולים עצביים המעורבים בפעילות ובקוגניציה, החל מתנועה וכלה בזיכרון. שיטה זו עזרה להבין גם תהליכים שתורמים להתפתחות מחלות ותסמונות: פרקינסון ואלצהיימר, טרשת נפוצה, אוטיזם, התמכרות לסמים ותסמונות חרדה. אפילו סייענו בהקמת חברה שתחקור יישומים של רקמות הידרוג'ל לצורך אבחון סרטן. שיטה זו מיושמת כעת לא רק במוח אלא גם באיברים שונים וברקמות שונות בגוף.
רואים רחוק רואים שקוף
יצירת מוח שקוף היא מסובכת כל כך עד שאפילו האבולוציה, במהלך מאות מיליוני שנים, לא השיגה יעד זה בבעלי חיים גדולים. שקיפות יכולה להעניק כמה יתרונות חשובים. ואכן בכמה מינים ביולוגיים התפתחה במהלך האבולוציה מידה מסוימת של שקיפות המשפרת את התאמתם של בעלי החיים האלה לסביבה (למשל כהסוואה מטורפים). בדמם של דגים מסוימים אפילו אין המוגלובין, החלבון האדמדם המעניק לדם את צבעו, והם למעשה מתקיימים בלי נוזל הדם הקיים אצל מרבית בעלי החוליות – כך הם משיגים מידה של שקיפות. אבל אפילו בעלי חיים אלו אינם מצליחים להפוך את מערכת העצבים המרכזית שלהם לשקופה, על אף לחצים אבולוציוניים חזקים. בדגים או בחסילונים שקופים באופן חלקי, מערכת העצבים אטומה לפחות במידה מסוימת. האבולוציה אולי יכולה לוותר אפילו על כדוריות דם אדומות, אבל נראה שדבר אינו מאפשר לאור לנוע באופן חופשי דרך מוח גדול חי.
האטימות לאור נובעת מכך שהאור מתפזר ברקמה עצבית. פוטונים מוחזרים משטחי המגע בין שומן ומים (בגלל ההבדלים במהירות שבו האור נע בשני חומרים אלו) ובכיוונים אקראיים לכאורה (בגלל המורכבות המבנית של החיווט העצבי). האבולוציה אינה יכולה לסלק בקלות את התופעה הזאת. המחסומים השומניים משמשים לא רק כקרומים לתאים או ולמבנים פנימיים במוח, אלא ממלאים גם תפקיד מפתח כחומר מבודד מבחינה חשמלית, המונע זליגה של היונים המעבירים את האותות החשמליים לאורך האקסונים המתפתלים. למרבה האירוניה, ביולוגים צריכים לשמור על שלמות המוח כדי להבין אותו, אך זה גם האיבר שהכי קשה לעשות אותו לשקוף.
ב-2009 נטלתי על עצמי את האתגר להפוך מוח שלם ובוגר לשקוף ועדיין לאפשר סימון מפורט של מולקולות שונות בתוכו. באותה עת, כבר החלו מאות מעבדות ברחבי העולם להשתמש בטכנולוגיה שעמיתי ואני פיתחנו ב-2004 עד 2009 ובאמצעותה אפשר להפעיל או להשתיק מעגלים עצביים ספציפיים במוח באמצעות אור. השיטה, המכונה אופטוגנטיקה, משלבת לייזרים, סיבים אופטיים וגנים שנלקחו מחיידקים ומאצות המקודדים חלבונים רגישים לאור הקרויים אופסינים. השיטה מאפשרת לשלוט באופן מדויק בפעילות העצבית בתאים ספציפיים במוח של חיות בשעה שהן רצות, קופצות, שוחות, מתקשרות או מבצעות פעולות מורכבות אחרות. בקיץ 2009, חמש שנים לאחר ההדגמה הראשונה של השימוש באופסינים של חיידקים, שהתקיימה ביולי 2004, נפתרו רוב האתגרים שעמדו בפני האופטוגנטיקה והיה אפשר ליישם את השיטה בקלות ובשימושים נרחבים. אף שאלפי תובנות חדשות התגלו בעזרת שיטה זו לגבי מנגנונים עצביים העומדים בבסיס ההתנהגות, האופטוגנטיקה לבדה אינה יכולה לספק סוג אחר של מידע נחוץ: תמונה ברזולוציה גבוהה המאפשרת הבנה של החיווט הכלל־מוחי של התאים היחידים שהופעלו באמצעות האור.
כל תחום במדע שואף לקשר בין מבט־על של מערכת ובין מרכיביה היחידים, אף שמטרה זו נזנחת לעתים קרובות (משיקולים מוצדקים). הפרדת מרכיביה של מערכת מורכבת כדי לחקור אותם בנפרד הייתה חיונית למדע תמיד, משום שהרחקת מרכיב מן ההקשרים המשפיעים עליו מאפשרת לנו לקבוע אילו מן התכונות מהותיות לו ואינן תלויות בשאר המרכיבים. אבל למבנה כמו המוח שהוא בעל קשרי גומלין עשירים, פירוק לגורמים של המערכת, בדיוק כמו פרימת חוטים באריג, אינה תמיד האסטרטגיה הטובה ביותר להבנת המערכת בשלמותה.
לצורכי דימות וסימון מרכיבים, האופי האטום לאור של מוחות יונקים בוגרים חִייב מאז ומתמיד פירוק של המוח, לרוב באמצעות חתכים, כך שלמעשה המבנה התלת־ממדי הפך למאות או לאלפי חתכים דו־ממדיים. התהליך הזה צורך כמויות אדירות של זמן וכסף, בעיקר כשנדרשים מוחות רבים כדי לייצר תוצאה משמעותית מבחינה סטטיסטית (כפי שקורה לא מעט כשחוקרים התנהגות יונקים). יותר מזה, מידע חיוני אובד לבלי שוב. מכיוון שבעזרת האופטוגנטיקה כבר התאפשר שימוש חדש במוח בשלמותו, התחלתי ב-2009 לתהות מה עוד אפשר לבנות במוח כדי לעזור לנו בבעיית פיזור האור.
גרעין הרעיון נטמן 15 שנה לפני כן. באמצע שנות ה-90, הסתקרנתי מן הרעיון לנסות לבנות מעגלים דמויי מוח במעבדה, ולהתחיל מתאים יחידים. דרך אחת לעשות זאת עשויה להיות באמצעות זריעת תאי גזע עצביים על פיגומים פולימריים, ושם על הפיגומים האלה יהיה אפשר באמצעים ביוכימיים לגרום לתאים להפוך לתאי עצב. במהלך ניסיונות אלו, התעמקתי בספרות המדעית וההנדסית של הידרוג'לים שנראו מוצלחים במיוחד כפיגומים בהיותם מתאימים לרקמות ביולוגיות וגם שקופים.
בשנים שלאחר מכן, ביצעתי בסופו של דבר רק ניסויים ראשוניים פשוטים שבהם זרעתי תאים על פיגומי פולימרים והפכתי אותם לתאי עצב, אבל מעולם לא הגעתי לשלב שבו יצרתי מבנה שלם דמוי מוח מתאים יחידים – משימה מאתגרת ביותר. ואף על פי כן, הקפדתי להעביר עִמי את הקלסר המאובק, שסומן בשם "הידרוג'לים" והכיל דפים מהודקים היטב, כשעברתי ממעבדה למעבדה במרוצת 15 השנים הבאות, ומשלב אחד למשנהו בקריירה שלי (קבלת תואר דוקטור בנוירוביולוגיה ב-1998, השלמת ההתמחות בפסיכיאטריה והתמחות פוסט-דוקטורט, והשקת מעבדת ההנדסה שלי באוניברסיטת סטנפורד ב-2004). אבל עיקרֵי התכנית כבר היו במוחי, והרעיון היכה שורש ובסופו של דבר התפתח, בעזרתם של כמה אנשים מוכשרים להפליא במעבדה, לאסטרטגיית עבודה לבניית מוח שקוף ונגיש.
סרטוט ששרבטתי בפברואר 2010, בזמן שישבתי אל שולחני לאחר תקופה ארוכה של מחשבות על דימות של המוח השלם, מתאר את הרעיון הבסיסי [ראו צילום]. הרעיון אמנם התבסס על העיקרון הישן של בניית מוח מתאים יחידים, אבל החידוש היה ליישם אותו בכיוון ההפוך: במקום להתחיל מהידרוג'ל ולבנות בתוכו מוח, עלה בדעתי להתחיל ממוח שלם ולבנות בתוכו הידרוג'ל. ההידרוג'ל ישמש כמבנה תומך שיישמר בתוכו את המיקום המרחבי של מרכיבי המוח החשובים לנו, כמו חלבונים וחומצות גרעין, אבל יאפשר סילוק של כל דבר אחר שמונע מאִתנו לצפות במעמקי המוח. בה בעת, ההידרוג'ל ימנע מן המוח לקרוס לעיסה חסרת צורה בזמן שממיסים או מעכלים מרכיבים פחות מעניינים.
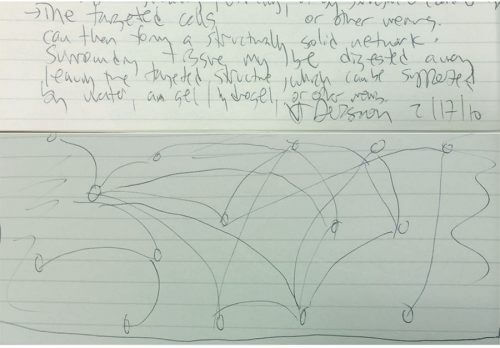
את הניסויים הראשונים, שגישרו בין תחומי מדע נפרדים והעניקו צורה מהוססת למה שהיה קודם לכן בגדר רעיון בלבד, אפשר להעריך באופן מיטבי רק בחלוף השנים כיש לנו די פרספקטיבה לבחון אותם. שתי חוקרות אמיצות ויצירתיות שהיו אז במעבדה – ויוויאנה גרדינרו ומנהלת המעבדה צ'ארו רמקרישנן – היו הראשונות שהסכימו ליטול על עצמן את הפרויקט הקשה הזה. הסיכון היה גבוה כל כך עד שהחלטתי לא לערב את כל הקבוצה. סברתי ששתי החוקרות המנוסות האלה (שכבר הצליחו מאוד בפרויקטים אחרים) יוכלו להתמודד עם הסיכון ועם האכזבה במקרה של כישלון.
בתחילת 2010, החלו גרדינרו ורמקרישנן לבחון איך להגן על תאי העצב מפני חומרים שיכולים להרוס את פרטי המבנה של הרקמה ואת קרומי התאים. באופן תיאורטי, מילוי תאי העצב בחומר פולימרי עמיד כלשהו יכול לספק את ההגנה: תאי העצב אמורים להישאר שלמים בתמיכה של הידרוג'ל. השתיים ניסו כמה אסטרטגיות, ובכללן החדרת גנים המקודדים אנזימים מסוימים שיאפשרו לתאי העצב לייצר פולימרים עמידים כמו כיטין או תאית. התברר שהגישה הטובה ביותר, שעלתה בעקבות רעיון יצירתי של גרדינרו, הייתה לייצר בתוך התאים פולימר ביולוגי אחר, קרטין. היא הראתה שבתאי העצב בתרבית, קרטין יכול להגן על מבנה התא והסיקה שבמוח השלם (כשתאי העצב מיוצבים בעזרת קרטין והידרוג'ל שמוסיף תמיכה חיצונית), יהיה אפשר לשטוף החוצה את השומנים בעזרת דטרגנט, ולחשוף את מבני המוח הרצויים, השרויים בתוך ההידרוג'ל השקוף.
באותה עת, בניית הידרוג'ל במוח השלם הייתה בגדר רעיון בלבד. החלטתי לזרז את הפרויקט בעזרת סיוע של מהנדס כימי. אף שאיש מחוץ למעבדה לא ידע על הפרויקט, חיפשתי בתיקיית הדואר הנכנס שלי פניות של מועמדים לפוסט-דוקטורט שעשוי להיות להם רקע מתאים בהידרוג'לים. בחיפוש צץ שמו של קוואנגון צ'נג, מהנדס כימי מוכשר ביותר שעבד אז במכון הטכנולוגי בג'ורג'יה. צ'נג שמע על עבודתנו בתחום האופטוגנטיקה ותאי הגזע, וביקש להצטרף למעבדה.
בתחילת מארס 2010, שבועות ספורים לאחר שסרטטתי את האיור המקורי של רעיון ההידרוג'ל, שוחחתי לראשונה שיחת טלפון קצרה עם צ'נג, בעת היותי בפגישה ביוטה. ואז עשיתי משהו שלא עשיתי בעבר (או מאז) משום שהייתי משוכנע כל כך בכיוון המחקר החדש. הזמנתי את צ'נג להצטרף למעבדה ללא ביקור במעבדה או אפילו ללא ריאיון פנים אל פנים. זמנים מוזרים למעבדה בנוירוביולוגיה: מהנדס כימי צץ משום מקום.
משהגיע, צלל צ'נג מיד אל תוך הפרויקט הסמוי. עד תום 2010, יצרו שלושת חברי הקבוצה במעבדתי קוביות שקופות של מוח עכבר שהיה אפשר לראות בהן בבירור, בתוך ההידרוג'ל, תאי מוח ששומרו בעזרת קרטין, אפילו בעומק של מאות מיקרונים בתוך הרקמה, עמוק בהרבה מכפי שהיה אפשר להגיע אליו בשיטות המצויות [ראו איורים]. ההידרוג'ל התפקודי הראשון שייצר צ'נג היה מבוסס על אַקרילאַמיד, המשמש לרוב במעבדות כדי להפריד חומצות גרעין או חלבונים. יצירי הכלאיים האלה של רקמה וג'ל תוכננו כך שנוכל להחדיר סמנים פלואורסצנטיים ואחרים באופן ישיר כדי לראות חלבונים משומרים ומבנים כמו אקסונים. לאחר מספר רב של מחזורי סימון גילינו שאיננו נזקקים כלל לקרטין כדי לשמר את מרכיבי התא במקום: ההידרוג'ל לבדו הספיק. על אף העבודה החלוצית בגישות אחרות שעשוהנס-אולריך דוט ואצושי מיאוואקי (שיטות 3DISCO ו- Scale בהתאמה), שקיפות ונגישות כזאת במוח בוגר של יונק לא הושגו עד כה.
שיטות ההידרוג'ל־רקמה מאפשרות גישה אל מעמקי המוח, ומספקות תובנות על הביולוגיה ועל מחלות של המוח.
גרסה זו של הידרוג'ל־רקמה המבוססת על אקרילאמיד (יש כיום גרסאות רבות אחרות שפורסמו) כונתה CLARITY, כעין ראשי תיבות של השם המלא. מאז שפרסמנו את השיטה ב-2013, אפילו גרסה יחידה זו של השיטה אומצה לצורך מגוון יישומים במדע בסיסי וכן ביישומים קליניים (למשל, בבדיקה לאחר המוות של מוחות של אנשים עם אוטיזם או אלצהיימר), וכן בחוט שדרה ובמוח של עכברים (למשל, לגילוי מסלולים עצביים השולטים בהתנהגות של פחד וחרדה שלא היו ידועים קודם לכן). מעבדות ברחבי העולם כבר פרסמו מאמרים רבים על מחקרים שבהם השתמשו בשיטה הזאת כדי להבין את המבנה הבסיסי של מערכת העצבים, לעתים קרובות בשילוב אופטוגנטיקה, וכדי להעלות רעיונות חדשים להבנת מסלולים עצביים תקינים ומשובשים.
בדיוק כשם שבמהלך חמש השנים הראשונות של שיטת האופטוגנטיקה באמצעות אופסינים חיידקיים פיתחו מדענים מגוון חידושים המאפשרים יישומים רחבי היקף של השיטה, כך גם השיטה לבניית הידרוג'ל בתוך המוח התקדמה באופן דרמטי בשנים הראשונות לאחר פיתוחה. לדוגמה, הגרסה המוקדמת ביותר של שיטת ההידרוג'ל כללה שלב שבו מאיצים באמצעות שדה חשמלי סילוק של חלקיקי דטרגנט טעונים שנקשרו לליפידים. שלב זה דרש מיומנות ולעתים, אם המתח היה גבוה מדי, הרקמה נפגמה. את הבעיה פתרו ראג'ו טומר, בריאן סווה ולי יה, שהיו אז כולם במעבדתי, שפרסמו בתחילת 2014 גרסה פשוטה יותר של השלב הזה בשני מאמרים (אחד בשיתוף עמיתים משוודיה). השיטה נודעה מאז בשם CLARITY פסיבי, כי היא אינה כוללת שדות חשמליים. טומר והקבוצה גם תיארו שיטת הדמיה מיוחדת של הידרוג'ל־מוח העושה שימוש בצורה מהירה ובעלת רזולוציה גבוהה של מיקרוסקופיה המכונה מיקרוסקופיה במשטחי אור, שהותאמה לעמוד באתגר של הדמיה מהירה של נפחי ג'ל גדולים באמצעות סריקת משטחים במקום נקודות אור.
בעת ההיא, הן גרדינרו והן צ'נג כבר עמדו בראש מעבדות מצליחות משלהם (במכון הטכנולוגי של קליפורניה ובמכון הטכנולוגי של מסצ'וסטס, בהתאמה), וכל אחת מהן ייצרה חידושים חשובים. עד מהרה הגיעו התפתחויות נוספות גם מחוקרים רבים אחרים. גרדינרו פיתחה באופן עצמאי ופרסמה אסטרטגיית CLARITY המתאימה לאורגניזם שלם ששמה PARS. גרדינרו וצ'נג פרסמו בנפרד נוסחאות הידרוג'ל חדשות הקרויות PACT ו-SWITCH בהתאמה, וכעת מעבדות ברחבי העולם תיארו כבר מגוון רחב של הרכבי הידרוג'ל־רקמה. אבל עד כה רק התחלנו רק לגרד את פני השטח בתחום הניסויי של חקר הידרוג'לים אפשריים. ב-2013 פרסמנו צ'נג ואני רשימה ארוכה מאוד של הרכבי הידרוג'ל אפשריים, מאקרילאטים ועד אלגיטנאטים ומעבר לכך. במעבדות שלי ושל עמיתי בוחנים כעת דרכים לעשות את הפולימרים פעילים אף יותר, למשל החדרת יסודות כימיים שיגרמו למוליכות חשמלית או לתגובתיות כימית ניתנות לכוונון, תכונות שיפתחו לפנינו אפשרויות חדשות.
אתגר נוסף מתמקד בתכונות של תצמידי הידרוג'ל־רקמה, שכפי שתיארנו במאמרים שלנו מ-2013 ומ-2014 גורמות לרקמות בתוך ההידרוג'ל להתרחב במידה ניכרת. התופעה אינה מעמידה קושי בכל המקרים ואינה מפריעה להדמיה ברזולוציה גבוהה, לא בשיטת ה-CLARITY המקורית ולא בשיטות מאוחרות ממנה (PACT/ePACT ב-2014, ולאחר מכן ExM/proExM ו-MAP ב-2015 וב-2016) שפיתחו קבוצות אחרות וגם הן גורמות להתנפחות הרקמה. אבל כדי שנוכל להשוות בין המוחות השקופים שיצרנו ובין אטלסים אקדמיים של המוח, יש צורך בשימור מדויק של הרקמה המקורית. משום כך, פיתחנו שלב אחרון, אפשרי, לכיווץ הרקמה בחזרה לגודלה המקורי.
בעזרת יֶה וחבר צוות אחר, ויל אלן, פיתחה מעבדתי ופרסמה תוכנת הדמיה וניתוח נתונים מהירה ואטומטית שאפשר להוריד ולהשתמש בה באופן חופשי. הקבוצה של עמיתי, מרק טסיה-לאוויין, אז באוניברסיטת רוקפלר וכיום נשיא אוניברסיטת סטנפורד, עשתה כן בעבור שיטת ה-iDISCO שהיא פיתחה. שני מאמרים משלימים אלו פורסמו באותו גיליון של כתב העת Cell ביוני 2016. הקבוצה שלי, ובה אמילי סילווסטרק, פריה רג'סתופתי ומתיו רייט, גם הצליחה לאפשר שימוש אמין בסוג חשוב במיוחד של סימון פלואורסצנטי במקביל של מספר רב של מולקולות רנ"א במוח השלם באמצעות שימוש בסוג אחר של הידרוג'ל, כפי שדיווחנו במאמר מוקדם יותר שהתפרסם ב-Cell במארס 20166.
"לאחר יצירת מוח שקוף, הקבוצה שלנו יכלה להסתכל על אזור הקרוי קליפת המוח הקדם־מצחית ולראות כיצד אוכלוסיות תאים המתווכות חוויות חיוביות או שליליות מחווטות באופן שונה."
היכולת לסמן כמה סוגי מולקולות, ובכלל זה חומצות גרעין כמו רנ"א, נעשתה יתרון ייחודי של גישת ההידרוג'ל והיא פותחת לנו אפשרויות נרחבות לחקר ביטוי גנים. ולאחר פתרון כל האתגרים האלה, רבים מהם רק השנה, השיטה הבשילה והגיעה לשלב שבו היא מיושמת במעבדות רבות ברחבי העולם.
קשירת הקצוות
מדהים להביט אחורה ולהשוות בין הסרטוט הצנוע מ-2010 ובין היישום התפקודי המלא, רק שש שנים לאחר מכן. יעד חשוב בהתקדמות חזון ההידרוג'ל היה לחבר בין שתי השיטות: אופטוגנטיקה של המוח השלם והשגת מידע מבני של המוח השלם. היעד הזה הושג ופורסם בכמה מאמרים, ובהם במאמר מיוני 2016 ב-Cell. המחקר שתואר במאמר הזה התמקד בקליפת המוח הקדם־מצחית, אזור שאחראי על ויסות תהליכים קוגניטיביים מורכבים ועל הרגשות. מדענים מקווים שהבנת האופן שבו המבנה הזה שולט על מגוון רחב כל כך של התנהגויות יוכל לספק תובנות לגבי מצבים פסיכיאטריים כמו אוטיזם וסכיזופרניה.
חברי הקבוצה שלי, יֶה, אלן וקים תומפסון, בשיתוף עמיתים ממעבדות אחרות, ובהן המעבדות של ליקון לואו וג'ניפר מק'נב, שתיהן בסטנפורד, השתמשו לראשונה באופטוגנטיקה כדי להגדיר קבוצת תאים בקליפת המוח הקדם־מצחית הפעילה בזמן חוויות מתגמלות כמו אוכל טעים במיוחד או אפילו קוקאין (וגם שולטת בתגובה ההתנהגותית המתאימה). לאחר מכן גילינו אוכלוסייה משלימה של תאים בקליפת המוח הקדם־מצחית הפעילים בזמן חוויות שליליות (בלתי נעימות). ולבסוף, בעזרת שיטות ההידרוג'ל החדשניות ביותר שלנו, הצלחנו להראות ששתי אוכלוסיות התאים האלה מחווטות באופן שונה זו מזו ברחבי המוח. התאים הקשורים בדברים חיוביים שולחים שלוחות בעיקר לאזור בעומק המוח הקרוי גרעין אקומבנס [ראו איור], ואילו התאים הקשורים לדברים שליליים מחוברים לאזור עמוק אחר הקרוי הַבֵּנולָה צדית. באופן זה, גישות ההידרוג'ל והאופטוגנטיקה מאפשרות למדענים לחקור רקמות ביולוגיות במצבן הטבעי בדרכים עוקבות שלא היו אפשריות בעבר, ומקדמות את ההבנה של ביולוגיה בסיסית ושל בריאות ומחלה.
ההערכה המלאה של מערכות מורכבות צצה במקביל ליכולת להחליף מידע הן בקנה מידה מקומי והן בקנה מידה רחב, בין שמדובר במוח השלם ובין שבמארג מורכב אחר. במדעי העצב, אפשר כעת לאסוף כמויות עצומות של מידע, הכולל פרטים עשירים ומגוונים המאירים את המבנה של המוח השלם, את מרכיביו המולקולריים ואת פעילות התאים. כתוצאה מכך, אנחנו מתחילים לעצב נקודת מבט רחבה ועם זאת מפורטת על המוח.
קשה וגם נדיר להשיג נקודת מבט רחבה כזאת שכוללת גם רזולוציה מקומית, אבל חשוב להיענות לאתגר. התכונות של מערכות מורכבות מקורן לעתים קרובות באינטראקציות מקומיות, כמו החוטים השזורים של שטיח וכמו התהליך המדעי עצמו. רק בעזרת נקודת מבט כוללת נוכל להבין את התפקיד שממלא כל חוט באריג.
