להדגמת הפוטנציאל הטמון במודלים אלה פיתחו החוקרים מהטכניון ומרמב"ם מודל של הפרעת קצב ברקמה עלייתית. המודל מדמה את הפרעת הקצב השכיחה ביותר – פרפור עליות – ומאפשר לבחון את השפעתן של תרופות רלוונטיות במניעת הפרעת הקצב או בהפסקתה לאחר שכבר התפתחה
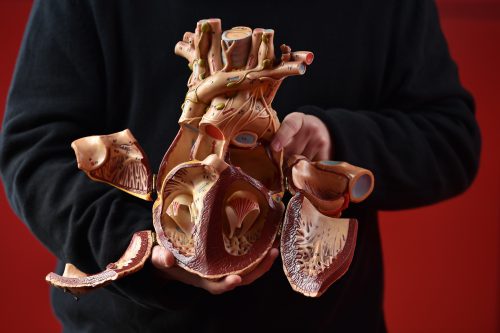
חוקרים בטכניון ובקריה הרפואית רמב"ם ועמיתיהם ב UHN– בית החולים המחקרי הגדול בקנדה – הצליחו להפיק במעבדה רקמות לב תלת-ממדיות מהונדסות מתאי גזע אנושיים מושרים. הרקמות, המדמות רקמות לב עלייתיות וחדריות, ישמשו בטווח הקרוב להתאמה אישית של תרופות למטופלי לב ולפיתוח תרופות חדשות עבורם. בעתיד הרחוק יותר צפויה הטכנולוגיה החדשה לשמש בייצור שתלים לאזורים פגועים בעליות הלב ובחדרים.
להדגמת הפוטנציאל הטמון במודלים אלה פיתחו החוקרים מודל של הפרעת קצב ברקמה עלייתית. המודל מדמה את הפרעת הקצב השכיחה ביותר – פרפור עליות – ומאפשר לבחון את השפעתן של תרופות רלוונטיות במניעת הפרעת הקצב או בהפסקתה לאחר שכבר התפתחה.
את המחקר שהתפרסם לאחרונה ב- Nature Communicationsהובילו פרופ' ליאור גפשטיין, ראש מעבדת סוניס לאלקטרופיזיולוגיה של הלב ולרפואה רגנרטיבית בפקולטה לרפואה ע"ש רפפורט ומנהל מערך הלב בקריה הרפואית רמב"ם, והדוקטורנטית עידית גולדפרכט. העבודה נעשתה במסגרת שיתוף פעולה המחקרי בין הטכניון ואוניברסיטת UHN בטורונטו, ובאופן ספציפי עם מעבדתו של פרופ' גורדון קלר.
ההישגים העיקריים המוצגים במאמר הנוכחי הם: ראשית, אם בשלב קודם הציגה קבוצת המחקר התקדמות מיצירת תאי לב בודדים מתאי גזע מושרים של מטופלים ליצירת רקמה דו-ממדית, הרי שכעת הושג מעבר לרקמה תלת-ממדית. שנית, במחקר הנוכחי מדדו החוקרים הן את הפעילות החשמלית של רקמת הלב המתקבלת באמצעות מערכת מיוחדת והן את הכוח המכני שהמערכת מייצרת – משתנה קריטי המשפיע באופן משמעותי על פעילותו התקינה של הלב. שלישית, אם בעבר הצליחה הקבוצה לייצר רקמה שהיא "שעטנז" של תאי לב שונים, כאן הצליחו החוקרים לייצר לחוד תאי עליה ותאי חדר – שני סוגי תאי שריר לב (קרדיומיוציטים) שהם קריטיים לתפקוד הלב אך פועלים באופן שונה.
"ההפרדה בין שני סוגי התאים," מסביר פרופ' גפשטיין, "חשובה משום שתרופות המשפרות את תפקוד תאי העלייה, וכך מונעות הפרעות קצב עלייתיות, עלולות להזיק לתפקוד תאי החדר ואף לעורר הפרעות קצב חדריות. לדוגמה, בפרפור עליות – הפרעת הקצב השכיחה ביותר, האחראית ליותר מרבע ממקרי השבץ המוחי – אנחנו רוצים להשפיע באמצעות תרופות רק על הפעילות החשמלית של תאי העלייה מבלי לפגוע בתפקוד הרקמה החדרית. כעת, כשאנחנו יכולים לייצר בנפרד תאי עליה ותאי חדר, נוכל לבדוק כל תרופה על כל אחד מסוגי התא לחוד.
הכלים המחקריים הייחודיים שפותחו במחקר הנוכחי – רקמות עליה ורקמות חדר מהונדסות, ושיטות חדשניות לחקור אותן – עשויים לחולל מהפכה בתחום פיתוח התרופות וכן ביכולת להתאים תרופות באופן אישי לחולה שממנו הופקה הרקמה (רפואה מותאמת אישית). בטווח הרחוק, מקווה פרופ' גפשטיין, "נוכל להשתמש בשיטות דומות כדי לייצר גם רקמות לב שישמשו להשתלות בחולי לב. רקמות אלה ייקלטו היטב משום שהן מבוססות על המאפיינים הגנטיים של המטופל עצמו ולא של תורם זר."
המאמר הנוכחי משלים מחקר קודם ממעבדתו של פרופ' גפשטיין, שהתפרסם לאחרונה בעיתון הקרדיולוגי המוביל Journal of The American College of Cardiology. באותו מאמר תואר מודל ייחודי דו-מימדי של רקמת לב ממקור תאי גזע אנושיים, המאפשר לחקור הפרעות קצב במחלות גנטיות. בעבודה זו, שבוצעה על ידי ד"ר ראמי שינואי ונעים שאהין מקבוצת המחקר של פרופ' גפשטיין, נעשה שימוש במודל האמור לחקר תסמונת גנטית מסוכנת בשם תסמונת ה-QT המקוצר. תסמונת זו עלולה להוביל למגוון הפרעות קצב ואף למוות פתאומי במטופלים צעירים. המודל שהציגה קבוצתו של פרופ' גפשטיין מאפשר לשחזר ולחקור את הפרעת הקצב הנוצרת, לבחון במעבדה טיפולים שונים ולבחור מראש את הטיפול האופטימלי עבור המטופל הספציפי. עבודה זו גם הדגימה אפשרות להשתמש בעריכה גנטית (CRISPR) לתיקון המוטציה המובילה להפרעת הקצב.
המודלים המהונדסים הדו-ממדיים והתלת-ממדיים המתוארים בשני מאמרים אלה מבוססים על יצירת תאי לב בטכנולוגיית תאי גזע פלוריפוטנטיים מושרים (human induced pluripotent stem cells, hiPSCs). טכנולוגיה זו פותחה בראשיתה על ידי החוקר היפני שינייה יאמנקה, חתן פרס נובל ברפואה לשנת 2012. אחד מיתרונותיה הבולטים של טכנולוגיה זו הוא האפשרות לייצר תאים ורקמות להשתלה מתאי גופו של המטופל עצמו – מה שמונע את בעיית הדחייה, האופיינית להשתלה של תאים שמקורם באדם אחר. התהליך, בתיאור פשטני, מתחיל באיסוף תאים בוגרים – תאי עור, למשל – מהמטופל. תאים אלה עוברים תכנות מחדש במעין "מנהרת זמן תאית" ומוחזרים למצב של תאי אב המזכירים תאי גזע עובריים. בהמשך ממוינים תאי האב במעבדה לרקמה הרצויה. במעבדתו של פרופ' גפשטיין, המתמקדת בגידול רקמות לב, משתמשים החוקרים בגורמי גידול שונים כדי לכוון את התמיינותם של תאי הגזע לתאי לב, וכפי שהודגם במאמר האחרון, אפילו לסוגים שונים של תאי לב: תאי חדר, תאי עלייה ותאי קוצב.
למאמר המדעי
