יכולתם של תאי המערכת החיסונית לבלום את תאי הסרטן, תלויה במידה רבה במרחק שבין הקולטנים שבאמצעותם הם בודקים ומזהים את התא ה”חשוד”
תאי דם לבנים (לימפוציטים) הם שומרי הסף של המערכת החיסונית שלנו. כמו שוטרי סיור שעוצרים מדי פעם חשודים, כך מסיירים הלימפוציטים בכלי הדם בגוף ויודעים להבחין בין תאים בריאים לתאים חולים שעלולים להתפתח בהמשך ולהפוך לתאים סרטניים. אם התא מזוהה כתא חולה – למשל תא נגוע בנגיף, או תא סרטני – “שוטרי הסיור” של הגוף מפרקים ומשמידים אותו. אם התא מסמן שהוא בריא, תאי הדם הלבנים מניחים לו להמשיך כרגיל.
לצורך תהליך הזיהוי, מצוידים תאי המערכת החיסונית בקולטנים – מולקולות היודעות לזהות ולהתחבר למולקולות אחרות (“ליגנדות”) המוצגות על פני תאים חשודים. ישנם קולטנים שבעת החיבור לליגנדה מסמנים לתא החיסוני לתקוף את התא החשוד, ויש כאלו המסמנים להימנע מתקיפה ו”לחוס” על התא הנבדק. האיזון העדין בין הסימנים מאפשר למערכת החיסונית לעשות את האבחנה בין סוגי התאים ולמנוע תקיפה של תאים בריאים. גילוי הקולטנים בולמי התקיפה הוביל בשנים האחרונות לפיתוח שיטת טיפול נגד מחלת הסרטן, המסייעת למערכת החיסון של הגוף לזהות ולתקוף תאים סרטניים. בשיטה זו אפשר לחסום ולנטרל את הקולטנים הבולמים, ולאפשר ללימפוציטים לתקוף את תאי הסרטן המתחזים לתאים בריאים.
על אף המחקרים הרבים שבוצעו בתחום זה עד כה, נותרו מספר שאלות פתוחות אודות מנגנון הפעולה של הקולטנים הבולמים, וביניהן השאלה: האם ואיך המרחק הפיזי בין הקולטן המסמן תקיפה לקולטן הבולם, משפיע על בלימת התקיפה? כאן נכנס לתמונה פרופ’ מארק שוורצמן מהמחלקה להנדסת חומרים באוניברסיטת בן-גוריון בנגב, שפיתחו שבב סיליקון שפני השטח שלו מדמים את פניו של תא סרטני, כך שהשבב מתפקד, למעשה, כמעין תא מלאכותי, המסוגל לקשור אליו את הקולטנים – ולסדר אותם על פי סדר מסוים.
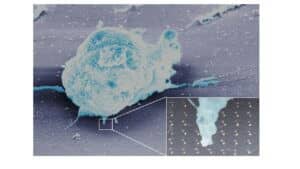
באמצעות שיטת ננו-ליתוגרפיה, שמקורה בטכנולוגיית ייצור שבבי מחשב, יצרו החוקרים שבב ועליו ציורים זעירים של נקודות ממתכות שונות בגודל של 10 ננומטרים.
באמצעות שיטת ננו-ליתוגרפיה, שמקורה בטכנולוגיית ייצור שבבי מחשב, יצרו החוקרים שבב ועליו ציורים זעירים של נקודות ממתכות שונות בגודל של 10 ננומטרים. אל הנקודות הדביקו, באופן כימי, מולקולות של ליגנדות הקושרות את הקולטנים, הן קולטני תקיפה והן קולטני בלימה. גודלן הזעיר של הנקודות מאפשר רק למולקולה אחת להיצמד לכל נקודה. השבב תוכנן כך שהמולקולות יסודרו במערכים שונים (מולקולות צמודות או מרוחקות באופן מבוקר).
ביתר פירוט: החוקרים הציבו על פני השבב לימפוציטים של אדם חי מסוג “תאי הרג טבעי” שאחראים על תפעול המערכת החיסונית. כך הצליחו להדגים שאכן הלימפוציטים הטבעיים “חשבו” שהם פגשו תא סרטני והפרישו חומריים רעילים לצורך תקיפה של תאי המטרה. עוד גילו החוקרים שתגובת התאים הייתה ושונה דרמטית בין מערך למערך ותלויה במרחק שבין הקולטנים. ככל שהקולטנים הלכו והתרחקו זה מזה, על השבב, כך הלכה ונבלמה הפרשת החומר הרעיל. תוצאה זו היתה הפתעה של ממש שכן היא מנוגדת לסברה שרווחה בקהילה המדעית, לפיה פעילות הבלימה בתא מחייבת קרבה פיזית בין שני הקולטנים. החוקרים הסבירו תוצאה זו בעובדה שמעטפת התא, הממברנה, היא בעלת גמישות מוגבלת. כך, כאשר הקולטנים צמודים, הם לא יכולים להתחבר ביניהם.
החוקרים אומרים שלמחקר זה שני היבטים חדשניים וחשובים – ננו-טכנולוגי וביולוגי. “כלים ננוטכנולוגיים מאפשרים ליצור, לראות ולשלוט באובייקטים בסדר גודל של 10 ננומטרים ואף פחות”, אומר פרופ’ שוורצמן. “זהו סדר גודל של מולקולה בגוף. באמצעות הכלים האלה, השגנו במחקר – שזכה במענק מחקר מהקרן הלאומית למדע, שליטה חסרת תקדים בסידור מולקולה כתא בודד ואף הצלחנו לראשונה ‘לכבות’ או ‘להדליק’ תהליכים חשובים המתרחשים בתא”.
גם בתחום הביולוגיה והרפואה ישנה חשיבות למחקר. ” הצלחנו להבין איך הגודל והסידור הפיזי של הקולטנים בתא משפיע על האופן בו הם ‘מדברים זה עם זה'”. מסביר השותף למחקר, פרופ’ אנג’ל פורגדור, דיקן הפקולטה למדעי הבריאות באוניברסיטת בן-גוריון בנגב. “להבנה זו יש חשיבות מרחיקת לכן בפיתוח שיטות אימונותרפיות נגד סרטן. כיום, אפשר לכוון את פעילות תאי המערכת החיסונית, באמצעות הנדסה גנטית של קולטנים, כך שייאבקו ביעילות רבה יותר בתאים הסרטניים. שיטה חדשנית זו נמצאת כיום בחזית הטיפול נגד סרטן וכבר הוכחה כיעילה נגד סוגים מסוימים של סרטן דם, אך כדי שאפשר יהיה להפעילה נגד סוגי סרטן אחרים, עדיין יש צורך בפיתוח נוסף”.
המחקר בוצע על ידי חוקרים במעבדות של פרופ’ מארק שוורצמן ופרופ’ אנג’ל פורגדור, בהובלת הדוקטורנטית אסתי טולדו והחוקרת הבתר דוקטוריאלית ד”ר גיום לה סו וכן קבוצות מחקר מגרמניה ומצרפת. צילומים: דני מכליס, אוניברסיטת בן-גוריון בנגב.
