חוקרים מאונ' תל-אביב שפכו אור על תעלומה בת 140 שנה במאמר שפורסם בנייצ'ר. המחקר מראה לראשונה כיצד מספר לא תקין של כרומוזומים (אנאפלואידיה) – תכונה ייחודית של תאי סרטן שהייתה מוכרת לחוקרים עשרות שנים – יכול להפוך לנקודת תורפה של תאים אלו. המחקר עשוי להוביל בעתיד לפיתוח תרופות שינצלו את נקודת התורפה הזו לצורך פגיעה ממוקדת בתאי סרטן
מה מייחד תאים סרטניים ביחס לתאים רגילים בגופנו? והאם ניתן לנצל את הייחודיות הזו כדי לפגוע בהם ולשתק את פעולתם? השאלה הבסיסית הזו מטרידה חוקרי סרטן מאמצע המאה ה-19 ועד ימינו, והחיפוש אחרי מאפיינים ייחודיים של תאים סרטניים הוא אבן בניין של מחקר הסרטן המודרני. מחקר חדש בהובלת חוקרים מאוניברסיטת תל-אביב מראה לראשונה כיצד מספר לא תקין של כרומוזומים (אנאפלואידיה) – תכונה ייחודית של תאי סרטן שהייתה מוכרת לחוקרים עשרות שנים – יכול להפוך לנקודת תורפה של תאים אלו. המחקר עשוי להוביל בעתיד לפיתוח תרופות שינצלו את נקודת התורפה הזו לצורך פגיעה ממוקדת בתאי סרטן.
המחקר, אשר התפרסם בכתב העת היוקרתי Nature, נערך במעבדתו של ד"ר אורי בן-דוד מהפקולטה לרפואה ע"ש סאקלר של אוניברסיטת תל-אביב, בשיתוף פעולה עם 6 מעבדות מ-4 מדינות נוספות (ארה"ב, גרמניה, הולנד ואיטליה).
אנאפלואידיה היא סימן היכר של מחלת הסרטן. בעוד בתאים נורמליים של בני אדם ישנם שני סטים של 23 כרומוזומים, אחד מהאב ואחד מהאם, בתאים אנאפלואידיים יש מספר שונה של כרומוזומים. כאשר אנאפלואידיה נוצרת בתאים סרטניים, לא רק שהתאים יכולים "לסבול" אותה, אלא שהיא יכולה אפילו לקדם את התהליך הסרטני. הקשר בין אנאפלואידיה לסרטן התגלה לפני קרוב ל-140 שנה, הרבה לפני ההבנה שמחלת הסרטן היא מחלה גנטית (ואף לפני גילוי הדנ"א כחומר התורשתי).
לדבריו של ד"ר בן-דוד, אנאפלואידיה היא למעשה השינוי הגנטי השכיח ביותר בסרטן. כ-90% מהגידולים המוצקים, כדוגמת סרטן השד וסרטן המעי הגס, ו-75% מסרטני הדם, הם אנאפלואידיים. עם זאת, אנחנו מבינים באופן מוגבל בלבד את האופן שבו התופעה תורמת להתפתחות והתפשטות הסרטן.
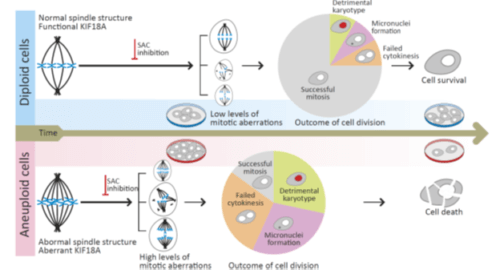
במסגרת המחקר, החוקרים יישמו שיטות ביואינפורמטיות (חישוביות) מתקדמות על-מנת לאתר אנאפלואידיה בקרב כאלף תרביות תאים סרטניים. לאחר מכן השוו החוקרים את הרגישויות הגנטיות של תאים בעלי רמה גבוהה של אנאפלואידיה לאלו של תאים בעלי רמה נמוכה, וכן את הרגישות שלהם לתרופות וחומרים כימיים שונים. החוקרים מצאו כי תאי סרטן אנאפלואיידים מפגינים רגישות מוגברת לפגיעה במנגנון הבקרה על הפרדת הכרומוזומים במהלך חלוקת התא (mitotic checkpoint).
בנוסף, החוקרים גילו את הבסיס המולקולרי לרגישות המוגברת של תאי הסרטן האנאפלואידיים. באמצעות שיטות גנומיות ומיקרוסקופיות, עקבו החוקרים אחר הפרדת הכרומוזומים בתאים שטופלו בחומר שידוע כמעכב של מנגנון הבקרה על הפרדת הכרומוזומים. החוקרים מצאו כי כאשר מעכבים את המנגנון בתאים בעלי הרכב כרומוזומלי תקין, חלוקת התא נעצרת. כתוצאה מכך, התאים מצליחים לבצע הפרדה תקינה של הכרומוזומים, ונוצרות בעיות כרומוזומליות מעטות יחסית. לעומת זאת, כאשר מעכבים את המנגנון בתאים אנאפלואידיים, חלוקת התא ממשיכה, אך מלווה בהיווצרות שינויים כרומוזומליים רבים שפוגעים ביכולת התאים להתחלק ואף מביאים למותם.
למחקר השלכות חשובות על תהליך הטיפול ברפואת סרטן מותאמת אישית. תרופות המעכבות את מנגנון הפרדת הכרומוזומים נמצאות כיום בניסויים קליניים, אך לא ידוע אילו חולים יגיבו לתרופות ואילו לא. בעזרת המחקר ניתן יהיה להשתמש באנאפלואידיה כסמן ביולוגי שעל-בסיסו ניתן יהיה לאתר את החולים שיגיבו לתרופות האלה טוב יותר. כלומר, לבצע התאמה של תרופות כימותרפיות קיימות לגידולים עם מאפיינים גנטיים ספציפיים.
פרט לכך, החוקרים מציעים למקד פיתוח של תרופות חדשות ברכיבים ספציפיים של מנגנון הבקרה על הפרדת הכרומוזומים, אשר זוהו כקריטיים במיוחד לתאים הסרטניים האנאפלואידיים. מנגנון הבקרה על הפרדת הכרומוזומים מורכב ממספר חלבונים. המחקר מראה כי הרגישות של תאים אנאפלואידיים לפגיעה בחלבונים השונים אינה זהה, וישנם חלבונים מסוימים אשר הפגיעה בהם חמורה יותר. לפיכך, המחקר מספק מוטיבציה לפתח מעכבים ספציפיים של חלבונים נוספים במנגנון הבקרה.
"יש להדגיש כי המחקר נעשה בתאים בתרבית ולא על חולי סרטן, ועל-מנת לתרגם אותו לטיפול בחולי סרטן יש לבצע עוד מחקרי המשך רבים. עם זאת, כבר בשלב זה ברור כי למחקר עשויות להיות מספר השלכות רפואיות" – מסכם ד"ר בן-דוד.
המחקר נערך בשיתוף פעולה עם מעבדות מחמש מדינות שונות: ד"ר זוזנה סטורכובה (האוניברסיטה הטכנית של קייזרסלאוטרן, גרמניה), ד"ר ג'ייסון סטמפף (אוניברסיטת וורמונט, ארה"ב), ד"ר סטפנו סנטגווידה (אוניברסיטת מילאנו, איטליה), וד"ר טוד גולוב (מכון ברוד של MIT והרווארד, ארה"ב).
עוד בנושא באתר הידען:
