תאי גזע הם כמו מעיין הנעורים – סם חיים שעתיד יום אחד לתקן שריר לב עייף ופגוע, או לשים קץ למחלה ניוונית. אבל המציאות רחוקה עדיין מהציפיות. מחקר שביצעו באחרונה פרופ’ דוד גבעול ושותפיו למחקר מהמחלקה לביולוגיה מולקולרית של התא במכון ויצמן למדע עשוי, אולי, בעתיד, להציע פתרון לחלק מהבעיות הכרוכות בשימוש רפואי בתאי גזע.

מחקרים רבים בתאי גזע מבוצעים בתאי גזע עובריים – התאים הראשוניים של העובר המתפתח. תאי הגזע העובריים מסוגלים להתמיין בכל כיוון ולהפוך לכל סוג תא בגוף. הודות לתכונה הייחודית הזו הם נחשבים לא רק לכלי מחקר אידיאלי, אלא גם – לפחות באופן תיאורטי – לתרופה אידיאלית, אשר עשויה להוות בסיס לטיפול בשורה ארוכה של מחלות, בפרט כאלה הקשורות בהזדקנות
ובניוון תאים. הבעיה היא, שהמקור היחיד לתאים אלה הוא עוברים של בני-אדם, דבר שמציב הגבלות אתיות על השימוש בהם.
בשנת 2006 הציע המדען היפני שיניה יאמאנאקה דרך לפתרון הבעיה, וגרם סערה בעולם המדע: מחקריו הראו, כי אפשר “לתכנת מחדש” תאי עור בוגרים, כך שיהפכו לתאים דמויי תאי גזע עובריים. תאים אלה אינם זהים לחלוטין לתאי גזע עובריים, אבל יש להם יכולת להתמיין לכל סוג תא. תהליך ה”תיכנות מחדש” של התאים היה פשוט במידה מפתיעה: התברר, כי די בהחדרת ארבעה גנים לתוך הדי-אן-אי של תא העור כדי להחזיר את השעון אחורנית, ולשנות תאים שגורלם נקבע לפני זמן רב. התאים החדשים קיבלו את השם (iPS(induced pluripotent stem.

“חשיבותה של התגלית הזאת”, אומר פרופ’ גבעול, “הייתה לא רק ביישומיה הביו-רפואיים העתידיים האפשריים, אלא גם בכך שהיא הפכה על פיה את ההנחה הישנה, שהתמיינות תאים היא תהליך חד-כיווני שלעולם אי-אפשר להחזירו לאחור”.
במציאות, אמנם, התאים שלנו “נעולים” בדרך כלל במסלול סגור, אך למעשה תאי כל הרקמות שלנו – משרירים ועד עור – מכילים את כל הכלים הגנטיים הדרושים כדי ליצור את כל סוגי התאים. כדי לתכנת אותם מחדש צריכים, במובן מסוים, לגלות כיצד להפעיל גנים מסוימים ולהפסיק את פעילותם של גנים אחרים, וכך לחזור למצב של תא הגזע העוברי. התברר, כי ארבעת הגנים הדרושים לתיכנות מחדש שייכים לקבוצת גנים קטנה אשר מפעילה גנים אחרים בתאי הגזע העובריים. לאחר התמיינות התא, גנים אלה “משתתקים”.
למרות פריצת הדרך, תאי ה-iPS החדשים אינם יכולים לשמש כמכשיר רפואי. הבעיה היא, שארבעת הגנים המוחדרים לתוכם לצורך התיכנות מחדש נשארים במקומם בתוך הדי-אן-אי, וממשיכים לפעול – ולהפעיל גנים נוספים – גם בשלב בו הם אמורים להשתתק. פעילות כזאת עלולה לחולל תהליכים סרטניים ומוטציות מזיקות. “למעשה”, אומר פרופ’ גבעול, “כל החדרה של די-אן-אי לתוך הגנום היא מסוכנת, ועלולה לגרום לתוצאות לא-צפויות”.

מסיבה זו, מאז שנוצרו תאי ה-iPS הראשונים מחפשים מדענים רבים דרך להימנע מהסיכון. בין היתר הוצעו שיטות מורכבות להוצאת פיסות הדי-אן-אי לאחר שסיימו את עבודתן. בגישה אחרת היא מחליפים את החדרת הגנים בהחדרה ישירה של תוצרי הגנים – חלבונים. אך שתי הגישות עדיין בעייתיות. פרופ’ גבעול, יחד עם עמיתיו, ד”ר אדוארד יעקובוב ופרופ’ שמואל (שפילק’ה) רוזנבלט מאוניברסיטת תל-אביב ופרופ’ גדעון רכבי מהמרכז הרפואי על-שם שיבא בתל-השומר ומאוניברסיטת תל-אביב, בחרו בדרך ביניים. השיטה שלהם מבוססת על הגורם המתווך בין הדי-אן-אי לחלבון: מולקולות האר-אן-אי-שליח (mRNA), אשר מובילות את התוכנית לייצור חלבונים מגרעין התא אל בתי החרושת לחלבונים – הריבוזומים. מולקולות האר-אן-אי מתפרקות לאחר זמן קצר – דבר שיכול למנוע את הבעיות הנובעות מחומר גנטי זר הנשאר בתא. תכונה חשובה אף יותר של האר-אן-אי היא, שהוא אינו משתלב בגנום, ולכן אינו מהווה סכנה להיווצרות מוטציות. מנגד, החלבונים שהוא מקודד נוצרים, מתקפלים ומעובדים על-ידי מכונות התא המאכסן, ולכן הם צפויים לתפקד כראוי וללא הפרעה בתוכו. המדענים יצרו במבחנה אר-אן-אי-שליח של ארבעת הגנים הנדרשים לתיכנות מחדש, והחדירו אותו לתאים בוגרים שגודלו בתרבית. הם חזרו על ההחדרה מספר פעמים, ולאחר שבוע ימים ביטאו התאים הבוגרים גנים אופייניים לפעילות של תא גזע עוברי. כאשר העבירו את התאים למשטח גידול אחר, התחילו התאים – שמקורם ברקמת חיבור – לגדל זרועות ארוכות האופייניות לתאי עצב. החוקרים קראו לתאים אלה iPS – RiPS שנוצרו באמצעות אר-אן-אי. נדרשים ניסויים נוספים כדי לבדוק אם התאים החדשים אכן ניחנים בכל תכונותיהם של תאי iPS.
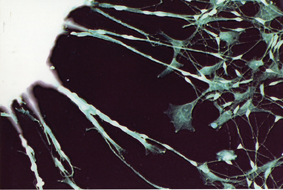
פרופ’ גבעול: “בשלב זה הוכחנו כי אפשר לבצע תיכנות מחדש באמצעות אר-אן-אי-שליח, וכי הוא משמש תחליף יעיל לדי-אן-אי. נראה ששיטות המבוססות על אר-אן-אי יתפסו חלק חשוב מאוד בתיכנות תאים”. מספר קבוצות מחקר, ובהן גם כאלה המקוות לפתח יישומים ביו-רפואיים, כבר גילו עניין בשיטה החדשה. פרופ’ גבעול: “תאי גזע המתוכנתים מחדש באמצעות אר-אן-אי עשויים לקדם את פיתוחה של רפואה אישית על-ידי תאים. בעתיד, אפשר יהיה ליצור תאי iPS באמצעות תיכנות מחדש של תאי של אדם בוגר, ובהמשך להפוך את תאי הגזע האלה לסוג התאים הרצוי – גם זאת באמצעות אר-אן-אי-שליח של הגנים האחראים להתמיינות הרצויה, כמו שריר, עצב וכדומה. תאים אלה יוכלו לשמש לטיפול במחלות רבות, כולל כאלה שכיום לא ניתן לרפאן”.

8 תגובות
אשמח לשמוע דעה מקצועית לגבי תפקוד תאי-גזע בתעשיית הקוסמטיקה.כמה זה באמת עובד.בתודה מראש.
שלום רב
האם יש טיפול חמלה בתאי גזע מושרים להנטינגטון?
מחלה יתומה שכמעט לא מתייחסים אליה.
תודה מראש נאוה
תודה רבה ר.ח.
דניאל,
התאור שלך לא מדוייק. מטרת החימום היא לפתוח את הדו-גדיל לשני חד גדילים ולא “לחצות את ה-DNA”
את הפריימרים אתה מוסיף לראקציה. הפריימרים הם 2 רצפי DNA חד גדיליים קצרים (כ 20 בסיסים) המתאימים וגובלים את הקטע אותו אתה רוצה להגביר.
הראקציה הכימית הקושרת את הפריימרים היא פשוט זיווג בסיסים רגיל של A-T ו G-C. מאחר והפריימרים קצרים טמפרטורת הקישור שלהם גבוהה מזו של החד סיב המקורי ולכן בטמפרטורת ה-annealing (בערך 60C, לפי רצף הפריימרים) הם ייקשרו אולם הסיב השני של ה- DNA לא ייקשר. הפולימראז מצטרף ומהפריימרים מעתיק את הטמפלייט אליו הם קשורים.
אני מקוהה שההסבר ברור ואם לא פשוט תסתכל על תרשים וזה יהיה ברור.
ארצה לשאול שאלה שלא בהכרח קשורה לקטע המוצג.ואשמח לתשובה מפורטת.
כאשר מכניסים גן כולשהוא למכשיר pcr, בשלב הראשון עליך לחמם את המכשיר ל- כתשעים מעלות סלציוס. כדי לחצות את הקטע הנתון לשניים.ומשם מתחבר הפריימר לאותו קטע (חצוי). ומשם המולקולה dna פולימראז. ממשיכה לבנות רצף תואם על גבי הקטע, וגורמת בכך לשיכפולו.ואני ארצה לדעת מהיכן מגיע אותו פריימר אל הקטע על מנת שהמולקולה תוכל להמשיכו. וארצה לדעת מהם הראקציות הכימיות הגורמות לכך.
אז למה השיטה לא יכולה לעבוד גם ביצירת חלבונים אחרים בתאים רגילים כמו אלה הדרושים במחלות גנטיות כמו סיסטיק פיבורוזיס.
או חלבונים שחסרונם מוביל ליצירת סרטן ועוד.
מישהו יכול להסביר ?
יפה, נשמע ממש טוב