חתן פרס נובל לשנת 2016 גילה ופענח את המנגנונים שבבסיס תהליך האוטופגיה (או אוטופאגוציטוזיס), תהליך יסודי לפירוקם ומחזורם של רכיבים תאיים

מכון קרולינסקה בשוודיה הודיע על הזוכה בפרס נובל לרפואה/פיזיולוגיה לשנת 2016 – פרופ' יושינורי אוסומי מיפן על תגליתו של מנגנון ה"אוטופגיה".
חתן פרס נובל לשנת 2016 גילה ופענח את המנגנונים שבבסיס תהליך האוטופגיה (או אוטופאגוציטוזיס), תהליך יסודי לפירוקם ומחזורם של רכיבים תאיים.
המונח אוטופגיה מקורה במילים היווניות "אוטו-", שמשמעותה "עצמי", והמילה "פגיאן", שמשמעותה "לאכול", כלומר – "אכילה עצמית". הרעיון החל לצמוח בשנות השישים של המאה הקודמת, כאשר חוקרים גילו בפעם הראשונה כי התא מסוגל להרוס בעצמו את תכולתו הפנימית באמצעות כמיסתם בתוך קרומיות, תוך יצירת שלפוחיות דמויות שק שהועברו לתוך מערכת ביולוגית שייעודה פירוק חומרים ביולוגיים בשם ליזוזום (lysosome). קשיים בחקר המנגנון הובילו לידע מוגבל ביותר בתחום זה, עד לתחילת שנות התשעים, אז, במסגרת סדרה של ניסויים מבריקים החוקר יושינורי אוסומי השתמש בתאי שמרים על מנת לזהות גנים החיוניים לתפקוד המנגנון. בשלב הבא הוא הצליח לפענח את המנגנונים שבבסיס התהליך בשמרים והוכיח כי מנגנונים מורכבים דומים פועלים גם בתאים שלנו.
התגליות הללו הובילו לפרדיגמה חדשה בהבנתנו את המנגנון באמצעותו התא ממחזר את תכולתו. התגליות שלו סללו את הדרך להבנת החשיבות היסודית של אוטופגיה בתהליכים פיזיולוגיים רבים, כמו ההסתגלות לתנאי רעב או התגובה לזיהום. מוטציות בגנים האחראים לתהליך עלולות לגרום למחלות, ובנוסף, התהליך עצמו מעורב במחלות מסוימות כגון סרטן ומחלות נוירולוגיות.
פירוק – תהליך מרכזי בכל התאים החיים
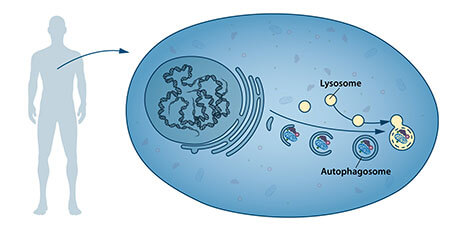
באמצע שנות החמישים של המאה הקודמת חוקרים שמו לב כי רכיב תאי ייעודי חדש, ששמו אברון (organelle), מכיל בתוכו אנזימים המפרקים חלבונים, פחמימות ושומנים. הרכיב הייעודי נקרא בשם "ליזוזום", והוא מתפקד בתור מפעל לפירוקם של רכיבים תאיים. לחוקר הבלגי כריסטיאן דה דוב הוענק פרס הנובל בפיזיולוגיה לשנת 1974 על הגילוי של הליזוזום. תצפיות נוספות בשנות השישים הראו כי כמות גדולה של תכולה תאית, ואפילו אברונים שלמים, יכולים להימצא לעיתים בתוך הליזוזומים. כלומר – לתא יש אפשרות להעביר כמות גדולה של חומר ביולוגי לתוך הליזוזום. מחקר ביוכימי ומיקרוסקופי נוסף הראה כי קיים סוג חדש של מנגנון להעברת חומר תאי בצורת שלפוחיות לתוך הליזוזום לשם פירוקו (איור 1). כריסטיאן דה דוב, החוקר שאחראי לגילוי הליזוזום, כינה את התהליך בשם אוטופגיה. האברונים החדשים נקראו בשם אוטופגוזומים (autophagosomes).
במהלך שנות השבעים והשמונים, חוקרים התמקדו בפענוח מערכת נוספת המשמשת לפירוק חלבונים ששמה פרוטאוזום (Proteasome). במסגרת תחום מחקרי זה זכו שלושת החוקרים אהרון צ'חנובר, אברהם הרשקו ואירווין רוז בפרס הנובל בכימיה לשנת 2004 על "הגילוי של פירוק חלבונים המתווך על ידי אוביקוויטין". הפרוטאוזום מצליח לפרק בהצלחה חלבונים, אחד אחר השני, אולם, מנגנון זה לא הצליח להסביר כיצד התא מרחיק תצמידי חלבונים גדולים יותר ואפילו אברונים שלמים שסיימו את חייהם.
ניסוי פורץ דרך
החוקר יושינורי אוסומי היה מעורב במגוון תחומי מחקר, אולם כאשר הוא הקים את מעבדתו שלו בשנת 1988, הוא התמקד במנגנון האחראי לפירוק חלבונים בחלולית (vacuole), אברון בתאי צמחים המקביל בתפקודו לאברון הליזוזום שבתאים אנושיים. תאי שמרים קלים יחסית למחקר, ולכן הם לעיתים קרובות משמשים כמודל לתאים אנושיים. הם שימושיים במיוחד באיתור גנים החשובים במסלולים תאיים מורכבים.
אולם, החוקר נתקל באתגר לא פשוט – תאי שמרים הינם תאים קטנים ולפיכך לא ניתן להבדיל בקלות בין המבנים הפנימיים השונים שבתוכם תחת מיקרוסקופ. החוקר הניח כי אם הוא ישבש את תהליך הפירוק בחלולית בזמן שתהליך האוטופגיה עדיין נמשך, אזי אוטופגוזומים אמורים להצטבר בתוך החלולית ולאפשר צפייה בהם בעזרת מיקרוסקופ. על כן, הוא גידל בתרבית תאי שמרים מוטנטיים שמהם הוצאו אנזימי הפירוק שבחלולית ובו זמנית האיץ את תהליך האוטופגיה על ידי הרעבת התאים.
התוצאות היו מדהימות – בתוך שעות ספורות החלוליות התמלאו באברונים קטנים שלא עברו פירוק (איור 2). אברונים אלו היו האוטופגוזומים וניסוי זה הוכיח כי תהליך האוטופגיה אכן מתרחש בתאי שמרים. תוצאות אלו היוו פריצת דרך מדעית מרשימה כאשר החוקר פרסם אותן בשנת 1992.

גילוי הגנים האחראים לתהליך האוטופגיה
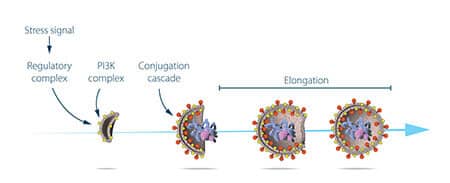
החוקר ניצל בשלב זה את זני השמרים המהונדסים גנטית שבהם הצטברו אוטופגוזומים בעקבות הרעבה. הצטברות זו לא אמורה להתרחש אם הגנים החיוניים לתהליך האוטופגיה יושבתו. החוקר חשף את תאי השמרים לחומר כימי הגורם למוטציות אקראיות ברבים מהגנים, ולאחר מכן הוא השרה אוטופגיה. האסטרטגיה שלו הצליחה – בתוך שנה ממועד הגילוי של תהליך האוטופגיה בשמרים, אוסומי זיהה את הגנים הראשונים החיוניים לתהליך. בסדרת ניסויים עוקבים, הוא הצליח לאפיין תפקודית את החלבונים המקודדים על ידי גנים אלו. התוצאות הוכיחו כי תהליך האוטופגיה נשלט על ידי סדרת חלבונים ותצמידי חלבונים, שכל אחד מהם מווסת שלב מובחן ומוגדר בייזום והתקדמות האוטופגוזומים (איור 3).
אוטופגיה – מנגנון חיוני בתאים שלנו
לאחר זיהוי המנגנון של תהליך האוטופגיה בתאי שמרים, נותרה שאלת מפתח – האם קיים מנגנון מקביל באורגניזמים אחרים? עד מהרה התברר כי מנגנונים כמעט זהים קיימים בתאים שלנו עצמם. כלי המחקר שנדרשו לחקר החשיבות של תהליך האוטופגיה בבני אדם כבר היו זמינים לחוקרים.
תודות לאוסומי ולחוקרים אחרים שבאו בעקבותיו, אנו יודעים כיום כי תהליך האוטופגיה אחראי לתפקודים פיזיולוגיים חשובים שבהם רכיבים תאיים נדרשים לפירוק ולמחזור. אוטופגיה יכולה לספק במהירות דלק ואבני בניין הנדרשים לחידושם של רכיבים תאיים, ולפיכך היא חיונית לתגובה התאית כנגד הרעבה וסוגים אחרים של עקה. לאחר התפתחותו של זיהום, תהליך האוטופגיה יכול להרחיק נגיפים וחיידקים שפלשו לתוך התאים. התאים מנצלים את תהליך האוטופגיה גם לשם שיכוך ההשלכות השליליות של תהליך ההזדקנות.
שיבוש של תהליך האוטופגיה נקשר למחלת הפרקינסון, לסוכרת מסוג 2 ולמחלות אחרות המופיעות בגיל מבוגר. מוטציות בגנים האחראים לתהליך עלולות להוביל למחלות גנטיות. שיבוש האוטופגיה נקשר גם להתפתחות סרטן. כיום נערך מחקר נמרץ במטרה לפתח תרופות המסוגלות להשפיע על תהליך האוטופגיה במגוון מחלות.
תהליך האוטופגיה ידוע מזה חמישים שנים, אולם החשיבות היסודית שלו בתחומי הפיזיולוגיה והרפואה זכתה להכרה רק לאחר מחקרו פורץ הדרך של פרופ' יושינורי אוסומי בשנות התשעים. על תגליותיו אלו, החוקר זוכה בפרס הנובל לשנה זו בתחום הפיזיולוגיה/הרפואה.
יושינורי אוסומי נולד בשנת 1945 במחוז פוקואוקה ביפן. הוא קיבל את תואר הדוקטור שלו מאוניברסיטת טוקיו בשנת 1974. לאחר שלוש שנים באוניברסיטת רוקפלר שבניו-יורק, ארה"ב, הוא חזר לאוניברסיטת טוקיו שם הוא הקים את קבוצת המחקר שלו בשנת 1988. מאז שנת 2009 הוא משמש כפרופסור במכון הטכנולוגי של טוקיו.

תגובה אחת
מה זה החרא הזה??? המידע פה לא שימושי בשיט