נפגשתי עם דר' לאונרדו סולמסקי כדי לשאול אותו מה עושים שם באוניברסיטה.
נפגשתי עם דר' לאונרדו סולמסקי כדי לשאול אותו מה עושים שם באוניברסיטה.
לפני מספר חודשים ראיינתי את שרון לפלר, דוקטורנט בקבוצה של פרופ' מיגל וייל במחלקה לחקר התא ואימונולוגיה בפקולטה למדעי החיים באוניברסיטת תל-אביב, בנושא פיתוח מודל-מחקר למחלות 'יתומות'. בסוף הראיון סיפר לי שרון על מערכת רובוטית חדשה וייחודית שמותקנת במעבדתם ויכולה לבדוק במהירות וביעילות את ההשפעה של מספר רב של חומרים על תאים 'חולים' כדי למצוא תרופות חדשות.
דר' סולמסקי אחראי על תפעול המעבדה הנקראת Cell screening facility for personalized medicine. ביקרתי אותו כדי לשמוע יותר על עבודתו הייחודית. את הידע על הטכנולוגיה הוא רכש במהלך התמחות במספר מעבדות בחו"ל ובעיקר באוניברסיטת הרווארד.
דר' סולמסקי נולד בארגנטינה ועלה לארץ בשנת 2003. הוא ביוכימאי, רוקח, וביולוג ואת עבודת הדוקטורט שלו עשה בפקולטה למדעי החיים באוניברסיטת תל-אביב. הוא נשוי + ילד, ובזמנו הפנוי אוהב לבלות עם המשפחה, לרוץ או לנגן מוזיקה.
לאונרדו, אז מה אתה עושה שם?
המטרה הכללית של המעבדה היא בדיקה ומיון של חומרים ומציאת מועמדים עבור תרופות למחלות נוירודגנרטיביות ולעיתים גם נדירות (APBD, ALS, FD, MNGIE, ועוד), ולכן אינן מהוות מטרה עבור חברות התרופות (מחלות 'יתומות'). העבודה נעשית באמצעות מערכת ממוחשבת וייחודית שמורכבת ממספר מכשירים המתואמים זה עם זה. שיטת העבודה נקראת high content screening, ובה מצלמים תאים חולים תחת מספר רב של טיפולים שונים ובעזרת התמונות מחפשים שינויים בפרמטרים שונים שיעידו על שיפור במצב. למרות שהיינו הראשונים לייבא אותה לארץ, כיום קיימות מערכות נוספות. עם זאת, אנחנו עדיין היחידים שעשינו אינטגרציה בין הרובוט למערכת איסוף התמונות ולאינקובטור. כלומר התהליך הוא אוטומטי מרגע הכנסת התאים ועד קבלת הנתונים מצילומם.
ספר לי על המערכת
המערכת כוללת רובוט שמבצע פעולות מכאניות להכנת הדגמים הנמדדים, מכשיר הנקרא 'IN Cell Analyzer 2000' המסוגל לצלם באורכי גל שונים מספר רב של תמונות בזמן קצר, אינקובטור אוטומטי המאפשר לגדל תאים בצורה מבוקרת על ידי הרובוט, ותוכנות לניתוח אוטומטי של התמונות (ראו תמונה 1). כל תהליך ההכנה מתבצע באווירה סטרילית במנדף ביולוגי.
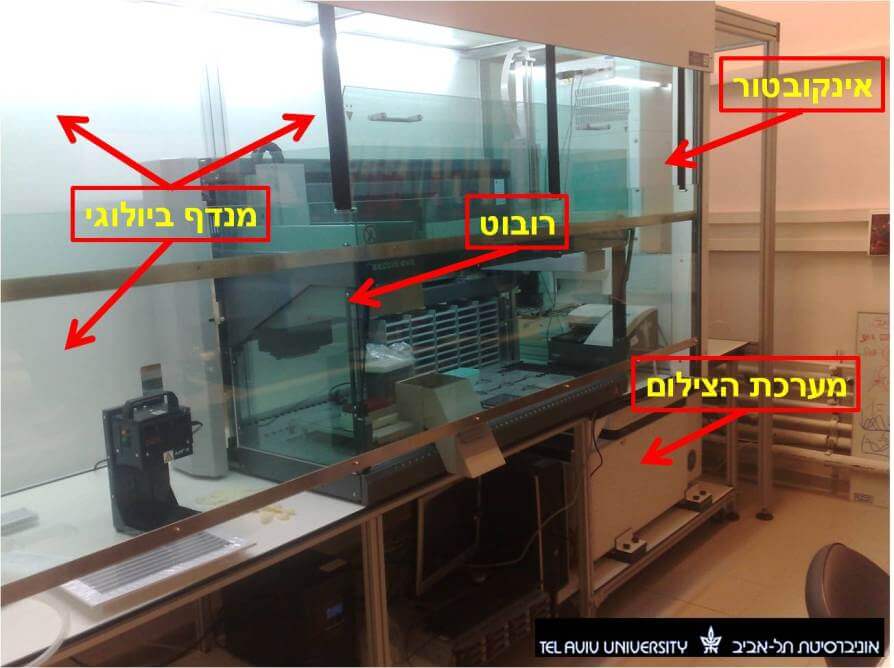
כיצד מתבצע ניסוי במערכת?
לפני תחילת הניסוי יש לאפיין את ההבדלים בין תאים בריאים לחולים מכיוון שיש בכוונתנו לחקור ולאפיין תגובה של תאים חולים לחומרים שונים. שלב הכנה זה נעשה אצלנו ביחידה מראש לפני תהליך ה-screening.
בתחילת הניסוי יש להכין את התאים שאנחנו מעוניינים לבדוק. כחלק מההכנה של התאים לניסוי אנחנו בדרך כלל משתמשים בצבענים פלואורסנטיים שונים לסמן אברונים שונים או חלבונים מעניינים בתא.
הרובוט המכאני מבצע את כל הפעולות הנדרשות להכנת הצלחות המכילות את התאים לצילום. אנחנו מספקים לרובוט צלחות מיוחדות עם מספר רב של באריות קטנות, מאגר של תאים ואת החומרים הרצויים, והרובוט עושה את כל השאר. הוא זורע את התאים בבאריות, מוסיף חומרים כשצריך ומוביל את הצלחות בין התחנות השונות במערכת. אנחנו רוצים לבדוק את ההשפעה על התאים של כ-20,000 חומרים שונים הלקוחים מספריית מולקולות קטנות. הרובוט מבצע את המשימה ביעילות, בדייקנות ובמהירות שאינן אפשריות עבור חוקר אנושי.
כיצד מתבצע הצילום?
הצלחת שמכילה מספר רב של באריות עם תאים שנחשפו לחומרים ולאחר מכן נצבעו, מוכנסת למכשיר הצילום על ידי הרובוט. כל בארית מצולמת במספר אורכי גל פלורוסנטיים בהתאם לצבענים שהשתמשנו. הצילום הוא מהיר מאוד, ברזולוציה גבוהה ובתמונה רחבה. לאחר הצילום התמונות נשלחות למחשבי האנליזה.
מהו תהליך האנליזה?
התהליך מכיל מספר שלבים. השלב הראשון נקרא סגמנטציה, ובו התוכנה מבדילה בין הפיקסלים שמכילים מידע ואלה שמהווים את הרקע. התוכנה מזהה אובייקטים בתמונה כגון תאים או גרעינים, כל אחד באורכי הגל בהם נצבעו. על מחשבי התחנה ישנן תוכנות המריצות אלגוריתמים שמתמחים בביצוע פעולות אלה, אך לשם קבלת תוצאה אופטימלית נדרשות התאמות עדינות המבוצעות על ידי המשתמש ודורשות מומחיות בתפעול וניסיון.
השלב הבא הוא חיבור התמונות של אורכי הגל השונים. לדוגמא אם התאים צבועים באדום והגרעינים בכחול, שלב הסגמנטציה יזהה את כל הפיקסלים האדומים שמרכיבים תא מסוים, ואת כל הפיקסלים הכחולים שמרכיבים גרעין מסוים. בשלב החיבור, שנקרא LINKAGE, תאחד התוכנה את כל הפיקסלים האדומים של התא עם כל הפיקסלים הכחולים של הגרעין שלו תחת אובייקט אחד שהוא אותו תא.
בשלב המדידה אנחנו מחליטים אילו פרמטרים אנחנו רוצים לנתח עבור אותם אובייקטים שזוהו על ידי התוכנה. אפשר להסתכל על הרבה פרמטרים בכל אחד מהאברונים שמרכיבים את התא כגון: מספר, גודל, עוצמת האות, היקף, צורה, מיקום, מרחק לאברונים אחרים, ועוד רבים, וגם להגדיר לבד פרמטרים חדשים.
אז מה אתם בדרך כלל מחפשים?
אנחנו עושים משהו שנקרא: Phenotypic drug discovery. אנחנו מחפשים בתמונות תחת אילו טיפולים נראים הפרמטרים של התאים החולים דומים יותר לבריאים. חומרים אלו יהיו מועמדים טובים עבור תרופות לטיפול במחלה.
אמרת שיש כ-20,000 באריות ועשרות פרמטרים, איך אתם עוקבים אחרי השינויים?
יש כמה שיטות להתמודד עם כל המידע הזה. ניתן לבצע כל מיני ניתוחים סטטיסטיים, ולהציג את המידע בצורות שונות. אני אתן לך דוגמא לאחת השיטות שנקראת Profile chart. בשיטה זאת אנחנו בוחרים לעבוד רק עם כמה פרמטרים שנראו שונים בין תאים בריאים לחולים בשלב האפיון המוקדם. את הערכים שנמדדו בתאים חולים שעברו טיפול אנחנו מנרמלים בין 0 ל- 100, כך שניתן להציג את כולם על אותו גרף. הגרף מכיל מספר פרמטרים בציר האופקי ואת ערכם המנורמל בציר האנכי, וצורתו היא המאפיין של תא, כך שכל התאים הבריאים, למשל, יראו תבנית דומה מאוד בגרף כזה, ושונה לזה שמראים תאים חולים (ראו תמונה 2). התוכנה יכולה לבצע ניתוח סטטיסטי על הגרפים שהופקו מהצילומים ולמצוא את החומרים שגרמו לדפוס הקרוב לזה של תאים בריאים. את כל זאת ניתן לעשות מבלי לנתח את השפעה של החומר על כל תכונה ותכונה באופן פרטני. זהו בעצם תהליך המיון של התרופות (drug screening), ועבור כ-20,000 חומרים הוא עלול להמשך כחודשיים (כולל ההכנה והמדידה של התאים).
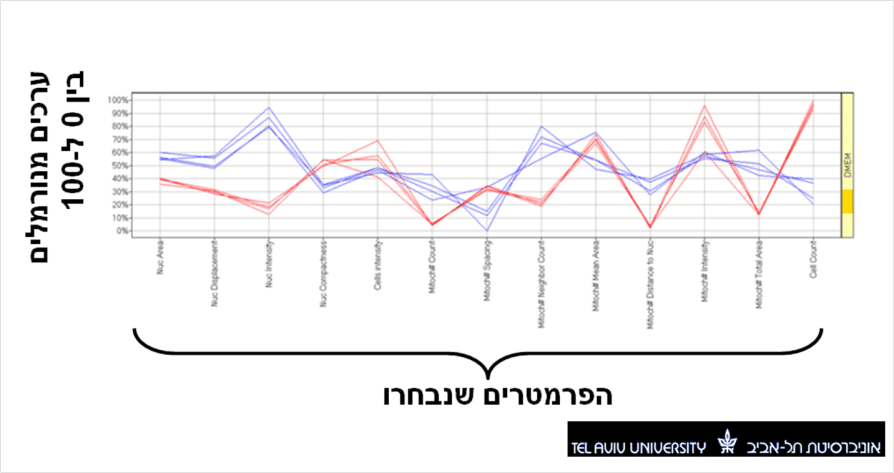
אז מה החזון שלכם לעתיד?
כפי שהסברתי, כיום אנחנו יכולים באמצעות המערכת לסרוק בזמן קצר יחסית מספר עצום של חומרים המועמדים לשמש כתרופות למחלות שונות. מה שאנו שואפים להקים בעתיד הוא מערך טיפול שבו ניתן לקחת תאים מאדם בודד ולהתאים לו תרופות באופן אישי בזמן ומחיר סבירים. זה החזון, ומכאן נגזר שמה של המעבדה: Cell screening facility for personalized medicine.

4 תגובות
תודה על התשובה (פתאום שמתי לב שיש לנו את אותו השם :-))
בכל אופן אני חושב שזה יכול להראות יפה גם בלי הקווים, פשוט היית רואה מקבץ של נקודות כחולות (או כתמים) באיזור מסויים עבור תאים בריאים, ומקבץ של נקודות אדומות באיזור אחר עבור תאים חולים.
הי אורן,
אני חושב שאני מסכים עם הנקודה שלך בתגובה הראשונה. אם הבנתי נכון את הגרף, מטרת הקווים היא ויזואלית בלבד. את מידת ההתאמה האמיתית בין הגרפים מוצאת תוכנת מחשב בעזרת אלגוריתמים מדויקים.
בזמן הראיון הראה לי דר. סולמסקי מסך מחשב עם עשרות גרפים כאלה. הקסם הוא שכאשר אתה מותח את הקווים אתה יכול די בקלות לאתר את ההתאמות אפילו ללא חישוב מדויק, רק מלהעיף מבט על הצורות.
דרך אגב אני מאד אוהב את השימוש שנעשה ברובוטים ובתהליכים אוטומטיים על מנת להאיץ את קצב העבודה והמחקר. הרובוט הזה הזכיר לי רובוט ממחקר אחר:
"Right now, it’s recording from a cell. It does this 24 hours a day, seven days a week. It doesn’t sleep and it never gets frustrated. It’s the perfect postdoc…. That’s when the robot goes to work…. it can generate hundreds of data points a day, or about 10 times more than an efficient lab technician…. So much of what we do in science isn’t actually science…. I say let robots do the mindless work so that we can spend more time thinking about our questions…. According to Markram, the patch clamp robot helped the Blue Brain team redo 30 years of research in six months"
http://seedmagazine.com/content/article/out_of_the_blue
קודם כל מרתק, ומוסבר בפשטות.
לגבי הגרף, לא הבנתי מה המשמעות של חיבור קווים בין הפרמטרים השונים על ציר ה X ? (כפי שרואים בתמונה) הרי לא מדובר על ציר זמן, אלו פרמטרים נפרדים ובלתי תלויים זה בזה (חלקם לפחות) מדוע לחבר בינהם קווים ולא להציג רק את הנקודות עצמן ?
סתם תוהה (למרות שויזואלית זה נראה נחמד, אבל חסר משמעות)