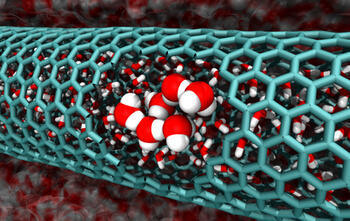
בשנים האחרונות חוקרים גילו כי מים זורמים באופן ספונטני בתוככי שפופרות זעירות במיוחד של גרפיט, גרפן, הקרויות ננו-שפופרות פחמן
מדענים חושפים לעיתים ממצאים מוזרים ובלתי צפויים כאשר הם מביטים בחומרים ברמה הננומטרית שלהם – הרמה של אטומים ומולקולות בודדים. הדבר נכון אפילו לגביי החומרים הנפוצים ביותר, כגון מים.
בשנים האחרונות חוקרים גילו כי מים זורמים באופן ספונטני בתוככי שפופרות זעירות במיוחד של גרפיט, גרפן, הקרויות ננו-שפופרות פחמן. תצפית בלתי צפויה זו מרתקת מאחר ובננו-שפופרות פחמן טמונה הבטחה בתחומים המתפתחים של ננו-זרימה וננו-סינון, שבהם ננו-שפופרות עשויות לסייע בשמירה על זרימות זעירות או בהפרדת זיהומים ממים. אולם, אף אחד לא הצליח להסביר כיצד, ברמה המולקולארית, נוזל יציב נוטה להגביל את עצמו לתחום כה קטן.
כעת, באמצעות שיטה חדשנית שבאמצעותה ניתן לחשב את הדינאמיקה של מולקולות מים, חוקרים מקלטק מאמינים כי הם הצליחו לפתור את התעלומה. מתברר כי אנטרופיה, המדד לחוסר סדר, היה הגורם החסר.
"זוהי תוצאה די מפתיעה," אומר William Goddard, פרופסור לכימיה, למדעי החומרים ולפיסיקה יישומית בקלטק. "חוקרים בד"כ מתמקדים בתחום זה באנרגיה ולא באנטרופיה." זאת מאחר ומים יוצרים רשת נרחבת של קשרי מימן, הגורמת להם להיות יציבים במיוחד. שבירת יחסי גומלין הדוקים אלו מחייבת השקעת אנרגיה. ומאחר ויש לבקע מספיק קשרים על מנת שהמים יזרמו בננו-שפופרות קטנות, לא סביר כי מים ייעשו כן בקלות כזו.
"מה שמצאנו הוא שזה בעצם סחר חליפין," מציין החוקר הראשי. "אתה מאבד קצת מהיציבות האנרגטית הטובה שמקורה בקשרים הכימיים, אולם אתה מרוויח באנטרופיה." אנטרופיה היא אחת מהכוחות הדוחפים שייקבעו בסופו של דבר האם תהליך כלשהו יתרחש מעצמו, אם לאו. מדד זה מייצג את מספר הדרכים שבהן מערכת יכולה להתקיים במצב מסוים. ככל שיש יותר סידורים אפשריים למערכת, כך גדול יותר חוסר הסדר שלה, וכך גבוהה יותר האנטרופיה. ובאופן עקרוני, הטבע נוטה לחוסר סדר.
כאשר מים קשורים באופן מיטבי, כל קשרי המימן "נועלים" את המולקולות במקומן, מגבילים את החופש שלהן ושומרים על אנטרופית המים נמוכה. החוקרים מצאו כי במקרה של מספר ננו-שפופרות, מים מקבלים מספיק אנטרופיה באמצעות כניסה לתוך שפופרות אלו כך שהיא עולה על אובדני האנרגיה שנגרמו כתוצאה מביקועם של מספר קשרי מימן. כתוצאה מכך, מים זורמים באופן עצמאי לתוך השפופרות. ממצאי המחקר פורסמו בכתב העת המדעי Proceedings of the National Academy of Sciences (PNAS).
החוקרים בחנו ננו-שפופרות פחמן בעלי קטרים המשתרעים בין 0.8 לבין 2.7 ננומטרים ומצאו שלוש סיבות לכך שהמים יזרמו בחופשיות בתוך השפופרות, בהתאם לקוטר שלהן. עבור ננו-השפופרות הקטנות ביותר – בין 0.8 לבין 1.0 ננומטרים – השפופרות כה זעירות שמולקולות המים מסתדרות בכמעט טור יחיד בתוכם והן במצב דמוי-גז. משמעות הדבר כי מבנה קשור רגיל של מים נוזליים מתפרק, ומעניק למולקולות הרבה יותר חופש לתנועתן. התגברות אנטרופיה זו מאפשרת את הכניסה של המים לשפופרת. עבור הקבוצה הבאה של השפופרות – אלו שהקוטר שלהן הוא בין 1.1 לבין 1.2 ננומטרים, מולקולות המים המוגבלות מתארגנות לכדי גבישים מגובבים, דמויי-קרח. החוקרים גילו כי ננו-שפופרות מסוג זה הן בעלות הגודל המושלם ל"אירוח" של מים גבישיים. במקרה זה יחסי הקישור בין הגבישים, ולא האנטרופיה, הם המאפשרים למים לזרום דרך השפופרות.
עבור הקבוצה בעלת הקטרים הגדולים ביותר, אלו המשתרעים בין 1.4 לבין 2.7 ננומטרים, החוקרים מצאו כי מולקולות המים המוגבלות מתנהגות יותר כמים נוזליים. אולם, שוב, חלק מקשרי המימן הרגילים מתפרק, כך שלמולקולות יש יותר חופש בתנועה בתוך השפופרות. והרווח באנטרופיה יותר מאשר מפצה על האובדן באנרגית קשרי המימן.
מאחר והחלק הפנימי של ננו-שפופרות הפחמן קטן מכדי שהחוקרים יוכלו לבחון אותו באופן ניסיוני, הצוות בדק את הדינאמיקה של מולקולות המים המתוחמות באמצעות הדמיות ממוחשבות. באמצעות שיטת חישוב חדשה הם הצליחו לחשב את האנטרופיה עבור מולקולות המים הפרטניות, בעוד שבעבר חישובים כאלו היו מאתגרים וצורכי זמן רב – השיטות הישנות צרכו 8 שנים של זמן מחשב על מנת לחשב את האטרופיות שעכשיו החוקרים מחשבים ב- 36 שעות בלבד.
הצוות הריץ גם הדמיות באמצעות תיאור חלופי של מים – כזה שבו למים יש את תכונותיהם הרגילות של אנרגיה, צפיפות וצמיגות, אך חסרה להם היכולת לקשרי מימן. במקרה הזה, המים לא נטו לזרום בתוך ננו-השפופרות, ממצא המספק עדות נוספת לכך כי קשרי המימן הנרחבים של מים רגילים, שלהם יש אנטרופיה נמוכה, הם המובילים למילוים של ננו-שפופרות הפחמן באופן ספונטני כאשר האנטרופיה גדלה.
החוקרים סבורים כי ננו-שפופרות פחמן תוכלנה לשמש בתכנון של סופרא-מולקולות לטיהור מים. באמצעות ייצור חרירים בעלי אותו הקוטר כשל ננו-שפופרות הפחמן, ניתן יהיה לפתח פולימר שמטרתו לקלוט מים מתוך תמיסה (של מי-ים, למשל).

5 תגובות
איש,
הנוסחה שמקשרת בין "יציבות" ונטיה של תהליך להתרחש מבוטא בנוסחת "האנרגיה החופשית של גיבס":
G = H − T*S.
G – אנרגית גיבס. באופן עקרוני, ככל שאנרגית גיבס יותר נמוכה אזי התגובה יותר נוטה להתרחש והתוצר הסופי שלה יותר יציב (נוטים לומר כי אם G של התוצר נמוך משל G של המגיבים, כלומר הפרש G שלילי, אזי התגובה הינה "ספונטנית").
H – אנרגית אנתלפיה, שמלמדת בעיקר על מידת "היציבות האנרגתית" של התהליך. כפי שניתן לראות, ככל שהאנרגיה יותר נמוכה אזי החומר והתהליך יותר יציב.
T – טמפרטורה.
S – אנתרופיה (אי סדר), ולכן ניתן לראות שככל שהאנתרופיה גבוהה יותר כך התהליך והתוצר הסופי שלה יותר ינטו להתרחש.
הערה קטנה: זוהי הוסחה תרמודינמית שמבטאת עד כמה "יציב" התהליך, אך אינה מלמדת ישירות על קינטיקה (כמה זמן ייקח לתגובה להתרחש).
כמובן זהו רק הסבר מאוד כוללני. אני יכול להסביר יותר אבל אני חושב שזה מספיק לענות על שאלתך.
מישהו אמר פרפטום מובילה???
מזכיר לי את מנוע אי הודאות האין סופי מ"מדריך הטרמפיסט לגלקסיה"
http://en.wikipedia.org/wiki/Technology_in_The_Hitchhiker's_Guide_to_the_Galaxy#Infinite_Improbability_Drive
איש,
זה לא טרייד אוף בין אנטרופיה לאנרגיה, אלא תחרות. מצב מסויים של מערכת יכול להיות עדיף יותר מבחינה אנרגטית, אבל בו זמנית עדיף פחות מבחינה אנטרופית. התשובה לשאלה מי מבין השניים יותר דומיננטי תקבע אם המערכת תעבור למצב זה.
אי אפשר לחבר תפוזים עם אבוקדו, לכן אין סכום כזה. במערכות סגורות האנרגיה (תמיד) קבועה, והאנטרופיה יכולה להשתנות.
תודה אבי, מעניין מאוד.
אם יש טרייד אוף בין אנתרופיה לאנרגיה, האם סכומם (אם ניתן לקרוא לזה כך) במערכות סגורות
ישאר על ערך קבוע?