חוקרים מהמכון הטכנולוגי של קליפורניה (Caltech) ואוניברסיטת קליפורניה בסן-דייגו (UCSD) שילבו חישובים תיאורטיים ומידע ניסיוני בכדי להראות כיצד עשויות שרשראות של חומצות אמינו להתקפל באופן ייחודי לחלבונים תלת-מימדיים מתפקדים.
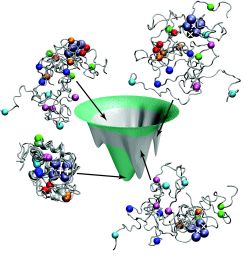
חוקרים מהמכון הטכנולוגי של קליפורניה (Caltech) ואוניברסיטת קליפורניה בסן-דייגו (UCSD) שילבו חישובים תיאורטיים ומידע ניסיוני בכדי להראות כיצד עשויות שרשראות של חומצות אמינו להתקפל באופן ייחודי לחלבונים תלת-מימדיים מתפקדים.
המאמר מתאר את ההתאמה של סידרת חישובים עבור קיפול חלבונים שנעשתה ע"י הצוות מ- UCSD (בראשותו של Peter Wolynes, פרופסור לכימיה, לביוכימיה ופיסיקה) עם תוצאות ניסיוניות שנאספו באמצעות שיטה חדישה שפותחה בקבוצת המחקר ב- Caltech (בראשותם של הכימאים Jay Winkler, Harry Gray ו- Arnold O. Beckman).
שיטת Winkler-Gray לצפייה בחלבונים במהלך התקפלותם משתמשת במצלמה בעלת זמני צילום של פיקו-שניות המסוגלת ללכוד הבזקים פלואורסצנטיים בעקבות העברה של פעימת לייזר בין שני בָּחוֹנים (probe), אחד מכונה תורם והשני מקבל. המרחק בין שני בחונים אלו משתנה במהלך הפיכתה של שרשרת חומצות האמינו לכדי חלבון תלת-מימדי מאורגן.
במאמר, שפורסם בכתב-העת המדעי PNAS, הקבוצות שילבו את השיטה הניסיונית של Caltech – שתוארה לראשונה בשנת 2002 במאמר שפורסם בכתב-העת המדעי Journal of the American Chemical Society – עם המודלים לקיפול חלבונים של Wolynes בכדי לבדוק אם הם יצליחו לקבל את מערך הקיפול המדויק של ציטוכרום סי, חלבון המהווה חלק ממסלול העברת האלקטרונים המיטוכונדריאלי הממיר מזון לאנרגיה תאית.
בתחילה נראה היה כי המודלים והממצאים הניסיוניים מתארים שני דברים שונים לחלוטין, מסביר Winkler. "החוקרים נדרשו להסביר את פעולות-הגומלין מטען-מטען בין חומצות אמינו שנראה כי הם החיוניים ביותר – כלומר, הדרך שבה מטענים זהים דוחים אחד את השני ואילו מטענים מנוגדים מושכים אחד את השני," הוא מסביר. "והם נדרשו להחשיב גם את פעולות-הגומלין ההידרופוביות – הדרך שבה החלקים "הלא קוטביים" של החלבונים נוטים לחבור יחדיו ולהידחות ע"י חלקים מימיים. כאשר המודלים שלהם התחשבו גם בתופעות אלו, הם התאימו לחלוטין לממצאים הניסיוניים."
"זו הייתה הפעם הראשונה שבה מישהו הצליח לפתח מודל תיאורטי שמסביר כהלכה את הממצאים שאספנו בניסויים שלנו במהלך השנים," מוסיף גריי.

8 תגובות
רענן:
בוודאי.
הכל תלוי בסביבה שמספקים למולקולה אבל אם מספקים את הסביבה הנכונה אז DNA היא כזאת מולקולה (וכן – יודעים לסנתז DNA )
בקישור הבא תמצא הסבר על הסביבה בה ניתן לגרום ל DNA לשכפל את עצמו:
http://en.wikipedia.org/wiki/PCR
תודה בכל אופן, אם למישהו יש הסבר קצר ובעברית אשמח לראותו.
בהנחה שאתה קורא אנגלית
http://theory-of-evolution.net/self-replicating-molecules-10.pdf
מישהו יודע אם יש מדענים הצליחו לייצר מולקולה כלשהי של חלבון או של חומר אחר שיכולה לשכפל את עצמה, עם אחוז קטן של מולקולות משוכפלות שלא זהים למולקולה ששיכפלה אותם?
תשובה ל Z
לצערנו זה לא ניתן. אין כיום ידע מספיק בנוגע לקשר בין המבנה המרחבי לבין סדר חומצות האמינו. כלומר, כיום עדיין לא ניתן להמציא חלבונים חדשים על-פי דרישה.
הערה לד"ר משה נחמני
קראתי את התרגום שלך, והוא אכן נאמן למקור – אך לצערי אין בהם כדי להסביר מה היה החידוש במאמר. כלומר: מה היתה התובנה העיקרית של הכותבים בנוגע לקיפול חלבונים. חבל, כי חוץ מלדעת שהם פרסמו משהו שקשור לקיפול חלבונים לא 'הרווחתי' מקריאת הכתבה. (גם אתה יודע שאנטראקציות אלקטרוסטטיות והידרופוביות אינן חידוש בפני עצמן. ההסבר הניתן בכתבה כלל אינו מספק.)
כמובן שאינני מתלונן, תודה על העדכון. אני מציין זאת אולי כדי 'לחלוב' מעט אנפורמציה נוספת..
(ניסיתי להוריד את הכתבה המקורית, אך ממקום מושבי הנוכחי אין לי הרשאה אוניברסיטאית. אם וכאשר אשים את ידי על המאמר המקורי אפרסם כאן תשובה לשאלתי. תודה.)
דוקטור, האם זה אומר שניתן עכשיו לעשות גם את ההיפך? כלומר לחשוב על מבנה תלת-מימדי בעל פעילות ספציפית רצויה, להזין אותו למודל המתמטי, ולקבל את סדר חומצות האמינו שיכול ליצור את המבנה הרצוי? האם יהיה ניתן לסנטז חלבונים חדשים לחלוטין?
בהחלט כן. ישנו מכשיר אוטומטי שנקרא עורך פפטידים (synthesizer) המסוגל לחבר חומצות אמינו בסדר מסויים. הבעיה קשורה לקיפול התלת-מימדי הנכון של החלבון כדי שיוכל להיות פעיל ביולוגית.
ד"ר נחמני, האם יש דרך לבנות חלבונים בדרך מלאכותית לחלוטין ע"י הרכבה ישירה של מולקולות?