כמה סוגי סרטן בשלבים מתקדמים מטופלים כיום בהצלחה באמצעות תאי חיסון מלאכותיים, שהם חזקים ומאריכי חיים יותר מכל תא חיסון המצוי באופן טבעי בגוף
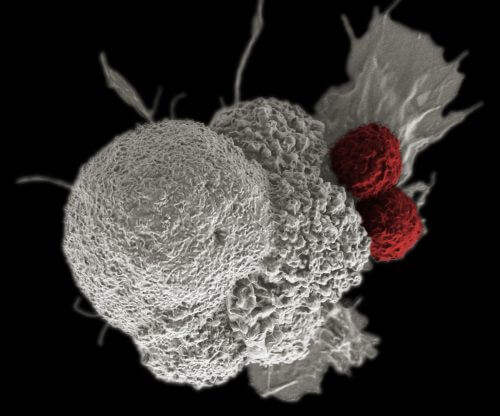
- תאי חיסון מלאכותיים, המכונים CAR T, נמצאו יעילים באופן מרשים בטיפול בלויקמיה ובלימפומה.
- תאים אלה מגבירים ומחזקים את כושרו של הגוף להיאבק בתאים ממאירים.
- אבל הם יכולים לחולל תופעות לוואי לא רצויות, ובמקרים מסוימים אפילו לגרום למוות. החוקרים מקווים לפתח עכשיו תאי CAR T חדשים שיתאימו לטיפול בסוגים נוספים של סרטן ויגרמו פחות תופעות לוואי.
אימונולוגים המתמחים בגידולים סרטניים יודעים כבר כמה עשרות שנים שמערכת החיסון עשויה להיות בת ברית חשובה במאבק במחלת הסרטן. עם זאת, רוב הניסיונות המוקדמים לגייס את היכולת שלה היו מאכזבים. מתברר שהחוקרים בעבר לא עשו די כדי לעורר רכיבים מרכזיים של מערכת החיסון, המתפקדים במערכת כמו רס"רים בצבא, הקרויים בשם תאי-T. ומערכת חיסון היוצאת לקרב נגד סרטן בלי להגביר את כושרם של תאי-T לזהות ולתקוף תאים סרטניים משולה לצבא היוצא לקרב מצויד במטוסי נייר ואבני קלע.
הרמזים הראשונים לכך שתאי-T זקוקים לחיזוק ניכר כדי שיוכלו להיאבק בסרטן התגלו במרוצת שנות ה-80 של המאה ה-20. החוקרים ניסו לחזק את התגובות של מערכת החיסון באמצעות שאיבה של תאי-T מגופם של חולים, אִפשרו להם להתרבות במעבדה ואחר כך החדירו את התאים הרבים בחזרה לדמם של החולים. השיטה הזאת עזרה למקצת המטופלים אבל לא לאורך זמן. התאים שהוחזרו לגוף איבדו בהדרגה את חיוניותם וחדלו לתפקד זמן לא רב לאחר שהוכנסו לגוף.
קבוצות שונות של חוקרים ניסו להתמודד עם הבעיה בדרכים שונות. אסטרטגיה אחת, שאנו ועמיתינו אימצנו, מראה לאחרונה סימנים מרַגשים להצלחה בניסויים קליניים. בשנות ה-90, בעת שניסינו לגלות טיפולים חדשים ל-HIV, פיתחו שניים מאִתנו (ג'וּן ולוין) טכניקה משופרת המסוגלת לתגבר באופן ניכר תאי-T שנלקחו ממטופלים. השיטה הגדילה את כמות התאים גם עשתה אותם עוצמתיים יותר ובעלי פעילות ממושכת יותר מכל מה שהושג בשיטות שרווחו באותה עת. ואז, לפני כעשר שנים, פיתחנו שיטה חדשה לשינוי גנטי של תאי-T שבעקבותיו היו התאים מסוגלים להתביית ולתקוף ביעילות תאים ממאירים מסוימים האופייניים לסרטן של תאי דם לבנים, כגון לויקמיה ולימפומה.
בשנים האחרונות נבדקו תאי החיסון המלאכותיים האלה, הידועים בשם "תאי-T בעלי קולטן כימרי לאנטיגן" (CAR T), בעשרות מחקרים שבכולם יחד היו מעורבים כמעט 1,000 חולים שסבלו מלויקמיה או מלימפומה בשלבים מתקדמים. מחצית או יותר מן החולים האלה, בהתאם לכל מחלה, חיים יותר מן הצפוי ונראה שאצל מאות מהם הסרטן נעלם.
בין החוקרים הולכת ומתגבשת הסכמה שלפיה טיפול באמצעות תאי CAR T, בין שהם לבד ובין שהם בשילוב עם אמצעי טיפול אחרים, עתיד לספק ריפוי לאורך זמן לסוגים מסוימים של סרטן דם. בהמשך, החוקרים צריכים לוודא שהטיפול הזה יעיל גם נגד סוגים אחרים של סרטן, ולמצוא דרך טובה יותר לוויסות תופעות הלוואי, שבמקצת המקרים עלולות להיות קטלניות. אבל ההצלחה שהושגה עד כה, הכוללת התמודדות עם שורה של אתגרים קשים במרוצת כמעט 20 שנה, בהחלט מעודדת.
תאי-T משודרגים
כשיצאנו לדרך שהובילה אותנו בסופו של דבר לתאי CAR T, המשימה הראשונה שלנו הייתה למצוא דרך להגביר את כושר ההרג של תאי-T שנלקחו מחולים. הייתה זו משימה לא פשוטה כלל. כדי שתאי-T יוכלו להתחיל לפעול, הם חייבים לקבל אותות מקבוצה אחרת של תאים המשתתפים במערכת החיסון הקרויים תאים דֶנְדְריטיים. רק לאחר שתאי-T מקבלים את האותות המתאימים, הם מסוגלים לממש את כושר הפעולה שלהם במלואו. כשזה קורה, הם מתחלקים פעמים רבות, מעמידים מספר עצום של תאים חדשים זהים להם (שכולם מכוונים לפגוע באותו יעד) ומשחררים מתוכם חומרים הקרויים ציטוקינים, המוסיפים ומגבירים את עוצמת התגובה החיסונית של הגוף. כעבור ימים מעטים תאי ה-T חוזרים לרמת התפקוד הבסיסית שלהם ומאפשרים למערכת החיסון ולגוף כולו לחזור לרמות תפקוד רגילות.
באמצע שנות ה-90, בעת שעבדו על HIV, החליטו ג'ון ולוין לשפר את התהליך הטבעי הזה באמצעות עירור של תאי-T במעבדה. התכנית שלנו הייתה לשאוב תאי-T מגופו של מטופל, לשפעל אותם, לעודד אותם להתרבות למספרים גדולים פי כמה מכפי שהם יכולים להתרבות באופן טבעי בגוף ולהזריק אותם בחזרה לאותו אדם. הם קיוו שהדבר להם להעצים במידה רבה את כושרה של מערכת החיסון של המטופל להיאבק ב-HIV ובשאר הזיהומים התוקפים אדם החולה באיידס.
אבל בתחילה היה עלינו למצוא דרך יעילה לשפעל תאי-T. באופן תיאורטי היה אפשר לחשוף אותם לתאים דנדריטיים שגם אותם בודדנו מכל מטופל, אבל תאים דנדריטיים שונים מאוד מאדם לאדם במספרם ובאיכותם, ובייחוד בין נשאי HIV או חולי סרטן. כדי לעקוף את הבעיה, החלטנו לפתח תחליפים מלאכותיים לתאים דנדריטיים. לאחר ניסיונות שונים, החלטנו להשתמש בכדורונים מגנטיים זעירים, וציפינו אותם במעטה של שני חלבונים המסוגלים לחקות את פעילותם המעוררת של תאים דנדריטיים, ואף לשפר אותה.
אחר כך אספנו תאי-T מדמם של מטופלים והמרצנו אותם לפעולה באמצעות הכדורונים הרב-תכליתיים שלנו. בסופו של התהליך, שנמשך בין חמישה לעשרה ימים, כל אחד מתאי-T של המטופלים שלנו התרבה והעמיד 100 תאים נוספים. השיטה שלנו המבוססת על כדורונים היא עכשיו אחד הכלים העיקריים העומדים לרשות חוקרים כדי לגדל תאי-T משופעלים, והם עושים בהם שימוש רב בניסויים לצורכי מחקר ובניסויים קליניים.
לעצב מחדש את תא-T
כשהגוף מתכונן לתגובה חיסונית נגד סרטן, עומדים לפניו שני אתגרים עיקריים. האחד, מקורם של התאים הממאירים בתאי הגוף עצמו. מאחר שמערכת החיסון התפתחה באופן כזה שהיא אינה מזהה את רקמות הגוף עצמו ואינה תוקפת אותן, היא מתקשה להבחין בין תאים סרטניים לתאים נורמליים. האתגר השני הוא שתאים סרטניים רבים מצוידים באמצעים מגוונים לדיכוי התגובה החיסונית. יש להם אמצעי הסוואה המסתירים אותם מתאי מערכת החיסון, והם מסוגלים גם להפריע ולשבש תגובה חיסונית יעילה.
תאי-T מצוידים באמצעי המונע מהם לתקוף תאים של רקמה בריאה. תא-T מזהה תא סרטני באמצעות זיהוי של שתי מולקולות המצויות על פני השטח החיצוני שלו. זיהוי שתי המולקולות האלה הכרחי לזיהוי התא כסרטני. רק אם הן מצויות שם, תא-T תוקף את התא. אחת מהן היא מבנה מולקולרי גדול הקרוי MHC המורכב מכמה חלבונים. המבנה כולל רכיב חלבוני המשמש כאנטיגן: מולקולה שהתאים הדנדריטיים "מציגים" לפני תאי-T ומפעילים אותם. המולקולה ההכרחית השנייה, המכונה ליגנד מעורר-נוסף (co-stimulatory ligand), מספקת את האות שאומר לתאי-T לתקוף. אם אחת משתי המולקולות, יחידת האנטיגן-MHC או הליגנד, אינה נוכחת על קרום התא החשוד, תא ה-T פשוט יתעלם ממנו. אם כך, לתא סרטני יש שני אמצעים להטעות תאי חיסון: הוא יכול להפסיק לייצר מולקולות MHC על פני קרום התא, או להציג על פניו צורה שונה של ליגנד מעורר-שותף המאותת לתאי-T להימנע מפעילות.
אבל מה יקרה אם תאי-T יעברו שינוי גנטי שיאפשר לחוקרים לתפוס את מקום התאים הדנדריטיים, ולבחור בעבורם את אנטיגן המטרה: למשל, אנטיגן המצוי בשפע על פני תאים סרטניים ואינו בהכרח מוצג על ידי מולקולות MHC? ומה יקרה אם תאי-T אלה לא יהיו חייבים לעבור את המהלך הדו־שלבי כדי להתחיל לתקוף תאים סרטניים? פיתוח הטכנולוגיה של תאי CAR T העמיד לרשות החוקרים לראשונה אמצעי שמקל עליהם לנסות את הגישה הזאת בפועל.
שלא כמו תאי-T רגילים, תאי CAR T תוקפים תאים סרטניים מיד אחרי שהם מזהים את מטרתם.
הפתרון היה להתאים לתאי-T גנים שיובילו ליצירת מולקולה סינתטית (CAR), המסוגלת לעשות את שני הדברים בה־בעת: לזהות את האנטיגן הנבחר (בידי החוקרים) ולשפעל תא-T גם בהיעדר אותות ההפעלה הרגילים. עלה בידינו להגשים את היעד הזה בשילוב רכיבים חלבוניים שהם למעשה נוגדנים (התוקפים בדרך כלל חיידקים ונגיפים) עם חלבונים נוספים שידוע שהם מעוררים תאי-T. ליתר דיוק, עיצבנו את החלק דמוי הנוגדן של CAR, המזדקר מפני קרום התא, כך שיוכל להתקשר לאנטיגן הסרטני הנבחר. נוסף על כך, הרכבנו את שאר תצמיד CAR, שחודר דרך כל קרום התא, באופן שהוא יפיק את האותות המתאימים ויפעיל את התא ברגע שהוא מזהה את האנטיגן הייחודי לסרטן.
הרעיון לתקוף אנטיגנים ספציפיים-לסרטן כדי להיאבק בגידולים ממאירים אינו חדש, כמובן. בשנות ה-90 החלו רופאים לטפל בחולים בנוגדנים הקרויים נוגדנים חד־שבטיים, המאתרים חלבונים ייחודיים המצויים בעיקר על קרומי התא של גידולים מסוגים שונים. אבל נוגדנים נשארים בגוף רק שבועות מעטים. לעומת זאת, כשמהנדסים אותם אל תוך תאי-T, הם ממשיכים להיות פעילים במשך כל חייהם של תאי ה-T, לפעמים במשך שנים.
האתגר הבא היה לגרום לתאי-T לייצר את המולקולה הרצויה של נוגדן-משפעל. החלטנו לנצל את הנטייה הידועה של נגיפי HIV להדביק תאי-T. סילקנו את הגנים שעושים את HIV לקטלני והחדרנו במקומם גנים המכילים את המידע הדרוש לבניית מולקולת הכלאיים שלנו, נוגדן-משפעל. אחר כך אפשרנו לנגיפים הבלתי מזיקים להדביק את תאי ה-T שהוצאנו מגופם של המטופלים שלנו. הנגיפים שעברו שינוי גנטי העבירו את הגנים לתוך תאי ה-T; משלב זה התאים המשיכו הלאה, יצרו תצמידי CAR ושילבו אותם במבנה קרומי התא שלהם. (ללא צורך ב-MHC או בליגנד מעורר-שותף.) יתר על כן, תא-T החדש הזה מהונדס כך שהוא יכול לצוד בדיוק את האנטיגן, או את צירוף האנטיגנים, שהחוקרים בחרו בעבורו.
באמצע שנות ה-90 ובתחילת שנות ה-2,000 למדנו, בשיתוף פעולה עם אחרים, להפוך תאי-T שנלקחו מחולים נשאי HIV לתאי CAR T ובדקנו את פעילותם בניסויים קליניים בבני אדם. אנחנו ממשיכים לשפר את השיטה שלנו ומצפים לפתח טיפולים מתקדמים יותר ב-HIV בעוד שנים מעטות.
תאי CAR T החלו להיבחן גם בטיפול בחולי סרטן, בידי כמה קבוצות חוקרים. אנחנו שאפנו לחבר טכנולוגיות – להשתמש במה שלמדנו על הפעלת תאי-T באמצעות כדורונים, יחד עם שיטת CAR, כדי לתכנן ולכוון מחדש תאי-T ונגיפי HIV בלתי מזיקים שישמשו כעין סוס טרויאני ידידותי שיחדור לתאי-T ויכניס לתוכם את המטען הייעודי של CAR.
עד מהרה גילינו כמה עוצמה יש בתאי CAR T אלה.
בוחנים את התכנון החדש
עכשיו עמדה לרשותנו עוצמת אש גבוהה דיה, וגם הרגשנו בטוחים שהמטרה שלנו נבררה היטב. האות המושלם שיאפשר לתאי-T שלנו להתביית על המטרה צריך להיות, כמובן, אנטיגן המצוי רק על תאים סרטניים, אבל אנטיגנים כאלה נדירים מאוד. מאחר שמוצאם של כל התאים הסרטניים הוא תאי גוף תקינים, הרי שתאים בריאים ותאים סרטניים בדרך כלל מציגים את אותם אנטיגנים על קרומי התאים. מובן מאליו שתאי CAR T שיהיו מכוונים כלפי האנטיגנים המשותפים יהרסו רקמות בריאות יחד עם רקמת הגידול.
עם זאת, יש כמה יוצאים מן הכלל חשובים. סוגים מסוימים של לויקמיה ולימפומה למשל, מתפתחים מקבוצה של תאי דם לבנים הקרויים תאי-B. אנשים יכולים לחיות ללא תאי-B, שהם יצרני הנוגדנים בגופנו, בתנאי שיקבלו מדי פעם בפעם עירויים של נוגדנים מוכנים. תאי-B, וכמוהם גם התאים הסרטניים המתפתחים מהם, נושאים על קרום התא חלבון בשם CD19. אנחנו וחוקרים אחרים בתחום סברנו ש-CD19 עשוי להיות מטרה מתאימה לטיפול בתאי CAR T מפני שהוא אינו מצוי בשום רקמה בריאה אחרת.
תחילה בדקנו את הרעיון על עכברים. בהמשך, בתחילת 2010, התחלנו לערוך ניסויים קליניים בתאי CAR T שהונדסו להתביית על CD19. שלושת בהמטופלים הראשונים היו בוגרים חולים שנמצאו בשלב מתקדם של לויקמיה לימפוציטית כרונית (CLL), ושלא הגיבו לטיפולים אחרים.
המטופל הראשון היה ויליאם לודוויג, סוהר בגמלאות שנודע לו שהוא חולה עשר שנים קודם לכן, ועתה היו בגופו תאי לויקמיה בכמות עצומה, כשני קילוגרמים וחצי, שהתפשטו בכל גופו. באוגוסט 2010 הוא קיבל חצי מיליארד תאים של עצמו שהכילו תאי CAR T מלאכותיים. כעבור עשרה ימים עלה לו החום, לחץ הדם שלו ירד והוא סבל מקשיי נשימה, תופעות לוואי קשות שהביאו לאשפוזו בטיפול נמרץ. מאוחר יותר התברר לנו שהתסמינים של לודוויג נבעו מכך שמערכת החיסון שלו נכנסה לפעילות מוגזמת במידה קיצונית בתגובה לכמות הגדולה של ציטוקינים שנמצאו בדמו, תגובה המכונה תסמונת שחרור ציטוקינים, והיא עלולה להיות קטלנית אם אין מצליחים לרסן אותה.
למרבית המזל, לודוויג התאושש וכעבור חודש לא מצאו הרופאים בביופסיה שלו שום סימן לנוכחות תאי-B סרטניים בגופו. התוצאה הזאת הייתה יוצאת דופן ובלתי צפויה במידה כזאת שהרופאים חזרו על הביופסיה כדי לאשש אותה, ואכן קיבלו אותה תוצאה. אחר כך טיפלנו בשני חולים אחרים, וגם אצלם התקבלו תגובות מפתיעות באותה מידה. יותר משש שנים אחר כך, לודוויג ואחד משני החולים האחרים עדיין חיים ואין בגופם לויקמיה. בדיקות נוספות הראו שתאי CAR T התרבו בזרם הדם ובמח העצם, הרקמה שמייצרת תאי דם. כל תא CAR T שהוחדר לגופם של שלושת המטופלים, או תאי הבת שלו, היה אחראי להמתה של 93,000-1,000 תאים סרטניים. כשתאי CAR T בודדו מדגימות דם של המטופלים חודשים לאחר הטיפול, הם שימרו את הכושר להרוג תאי לויקמיה שנשאו את המולקולות CD19 בתנאי מעבדה. למעשה, המגנים האלה התנהגו כ"תרופה חיה" ארוכת טווח, הממשיכה לסבוב בגוף וללכוד כל הופעה מחודשת של תא ממאיר.
מרחיבים את הרפרטואר
על אף התוצאות הראשוניות המשמעותיות שהשגנו, התקציב שלנו אזל ולא יכולנו לנסות את הטיפול הניסויי שלנו על חולים נוספים. ועדות של סוכנויות מחקר פדרליות שבחנו את עבודתנו קבעו שהטיפול מסוכן מדי ואינו מצדיק מימון נוסף. אף על פי כן, הגשנו שני מאמרים המתארים את התוצאות של שלושת המטופלים הראשונים, והמאמרים התקבלו במהרה והתפרסמו יחד באוגוסט 2011 בכתבי העת New England Journal of Medicine ו- Science Translational Medicine. הפרסום הביא לסקירה נרחבת באמצעי התקשורת, וגם להתעניינות רבה מצד קבוצות הזנק וחברות ביוטכנולוגיות שפנו לאוניברסיטת פנסילבניה, שם עבדנו, והתעניינו באפשרות לקבל רישוי לטכנולוגיה.
בסופו של דבר, אחת מבקשות המענק שלנו נענתה בחיוב וכך יכולנו לערוך ניסוי קליני נוסף שהחל ב-2012, והפעם בילדים. בהמשך החלטנו להקים שותפות של אוניברסיטת פנסילבניה עם חברת נוֹוַרטיס כדי לממן את המשך הפיתוח ואת הגשת התוצאות ל-FDA כדי לקבל אישור לשימוש מסחרי בשיטה. השותפות התניעה מרוץ מטורף של מרכזים רפואיים רבים בכל העולם, שהקימו חברות ביוטכנולוגיה חדשות המיועדות לייצור גרסאות חדשות של תאי CAR T. התוצאות המאוחרות ביותר שלנו בילדים מראות שיעורי הישרדות של 62% כעבור שנה, בהשוואה לשיעורי הישרדות נמוכים מ-10% כעבור שנה, בהשפעת טיפולים סטנדרטיים.
במרוצת השנים האחרונות, דיווחו קבוצות רבות, ובהן המרכז לסרטן של סלון-קטרינג, בית החולים לילדים בסיאטל, המרכז לחקר סרטן על שם פרד האצ'ינסון שחברו לחברת Juno Therapeutics, המכון הלאומי לסרטן שחבר ל-Kite Pharma, ואחרים, על תגובות מפתיעות של חולי לויקמיה ולימפומה בשלבי מחלה מתקדמים. במרכז שלנו טיפלנו ב-300 חולים בתאי CAR T המתבייתים על מחלות ממאירות של תאי-B. שיעורי התגובה משתנים בהתאם למחלה: כמחצית מן המטופלים שלנו שחלו בלויקמיה לימפוציטית כרונית בשלב מתקדם מראים שיפור קליני מובהק (בהסתמך על ירידה במספר התאים הלויקמיים בגופם, לצד גורמים אחרים), ואילו כ-90% מן הילדים החולים בלויקמיה לימפובלסטית חריפה (ALL) הראו תגובה מלאה: היעדר סימנים לנוכחות תאים סרטנים חודש לאחר הטיפול.
איננו יודעים מדוע טיפול בתאי CAR T אינו פועל אצל כל החולים עם ממאירות נושאת CD19. במקרים מסוימים יש נסיגה כנראה משום שתאי CAR T לא התרבו בגוף המטופל, או משום שהופיעו תאים לויקמיים חדשים שאינם מייצרים CD19 ולכן אינם מושפעים מן הטיפול. גם כך, היקף התגובה לטיפול במחלות סרטן אלה הוא ללא תקדים. ב-2017 צפוי ששתי חברות יבקשו מ-FDA לאשר שימוש בתאי CAR T לטיפול בסרטן: נוורטיס, לטיפול בלויקמיה לימופאידית חריפה בילדים ומאוחר יותר בלימפומה, וחברת קייט (Kite) לטיפול בסוג מסוים של לימפומה.
אתגרים רבים עדיין ניצבים בפנינו. קהילת המחקר עדיין עסוקה בפיתוח דרכים להקל ואולי למנוע את תופעות הלוואי הקשות ביותר. גם אם מקרי מוות בקרב המטופלים הם נדירים, הרי כמה חולים שסבלו מלויקמיה לימפובלסטית חריפה מתו עקב בעיות הקשורות לטיפול, ככל הנראה בשל בריאותם הכללית שהייתה רעועה במיוחד, ואולי גם בגלל הבדלים במבנה תאי CAR T שנעשה בהם שימוש במכוני המחקר השונים.
אנחנו מצויים עכשיו בשלב "מודל T" של פיתוח תאי CAR T. העדיפות הראשונה שלנו היא להרחיב את הזמינות שלהם לחולים עם סרטן של תאי־B וגידולים אחרים, וכמה חידושים מדעיים וטכנולוגים מן העת האחרונה יעמדו במבחן של ניסויים קליניים בשנים הקרובות. כדי לטפל במחלות סרטן שאינן קשורות לממאירות של תאי-B, חוקרים צריכים מן הסתם לאתר צירופים של אנטיגנים מסוימים השכיחים יותר על תאים סרטניים מאשר על תאים של רקמות בריאות, ולהתמקד בהם. אחד מאִתנו, לדוגמה (פוסי), מנסה לפתח טיפול המבוסס על מערכת החיסון לסרטן השד ולסרטן הלבלב. הסרטנים האלה ואחרים, שהם מחלות של גידולים מוצקים מיטיבים להסתתר ולדכא את מערכת החיסון הטבעית, יותר מלימפומה ולויקמיה החשופות יותר לטיפול מפני שהתאים שלהן סובבים במערכת הדם. כדי לאתר את התאים של גידולים מוצקים, פוסי מתכנן תא CAR T שיתביית על שתי מטרות במקום אחת: האחת היא מולקולה של סוכר מסוים המצויה רק על קרומים של תאים סרטניים ומאפשרת להם להתרבות מהר יותר מתאים בריאים; השנייה היא מולקולה של חלבון המצויה הן על תאים בריאים והן על תאים סרטניים. באופן תיאורטי, השילוב של מולקולת הסוכר עם החלבון צפוי להימצא בשכיחות גבוהה רק על תאים סרטניים, דבר שאמור להגביל את כושרו של תא CAR T מסוים זה להזיק לרקמות בריאות.
רק לעתים רחוקות ההתקדמות בתחום זה מתרחשת בקו ישר. אכזבות, השערות שגויות ועיכובים הם בלתי נמנעים. אבל אין לנו צל של ספק שההצלחה שכבר הושגה בטיפול בלויקמיה ובלימפומה מצדיקה את המשך המחקר והפיתוח של תאי CAR T נוספים.
גילוי נאות: כמו חוקרי סרטן רבים אחרים, יש למחברים קשרים מסחריים עם כמה חברות הפועלות למטרות רווח. אייברי ד' פוסי מחזיק בקניין רוחני והוא נתן רישיון לשימוש בו לחברת נוורטיס ולחברת Tmunity Therapeutics המפתחת טיפולים בסרטן. קארל ה' ג'ון וברוס ל' לוין מקבלים תמלוגים ומימון למעבדה מחברת נוורטיס, תמורת רישיון המתיר להם שימוש בקניין רוחני והסכם עם אוניברסיטת פנסילבניה. נוורטיס ואוניברסיטת פנסילבניה הגישו בקשה לפטנטים על תרופות המסתמכות על חלק מעבודת המחקר המסוכמת במאמר זה. ג'ון ולוין הם מייסדים-שותפים ובעלי מניות בחברת Tmunity Therapeutics והם מקבלים גם תשלומים על ייעוץ ומייעצים לכמה חברות המעורבות בטיפול באמצעות תאים ובחקר סרטן. הקשרים האלה מנוהלים בהתאם למדיניות של אוניברסיטת פנסילבניה וכפופים לפיקוחה.

2 תגובות
סירטון מדהים