חוקרים באוניברסיטת תל אביב פיתחו גישה חדשה לחיסול ממוקד של תאי סרטן אלימים על ידי הצתת מנגנון חיסול עצמי בתא.
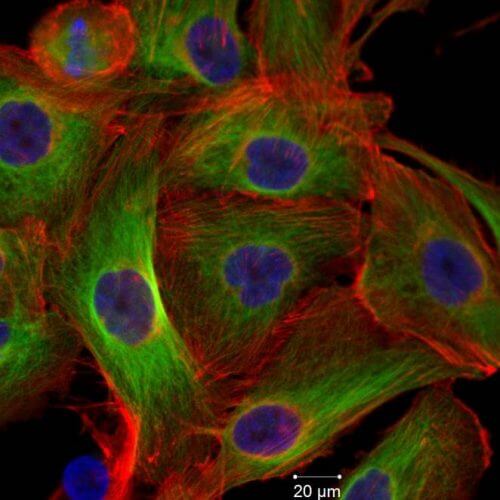
חוקרים באוניברסיטת תל אביב גילו כיצד ניתן לרתום מנגנון מוות מהיר טבעי שקיים בכל תא, ומגן מפני שגיאות בחלוקת התא, על מנת לחסל תאים סרטניים אלימים ועמידים לטיפולים הקיימים.
המחקר בוצע בהובלת פרופ' מלכה כהן-ערמון מהחוג לפיזיולוגיה ופרמקולוגיה בפקולטה לרפואה של אוניברסיטת תל אביב, בשיתוף עם קבוצותיהם של פרופ' תמר פרץ במכון האונקולוגי שרת במרכז הרפואי הדסה עין כרם, ופרופ' שי יזרעאלי וד"ר טליה גולן במרכז לחקר הסרטן במרכז הרפואי שיבא בתל השומר. המאמר פורסם לאחרונה בכתב העת Oncotarget.
"כבר ב-2009 גילינו שמולקולות שהן נגזרות של פננתרידינים (פחממנים תלת טבעתיים) הורגות ביעילות תאים של סרטן שד גרורתי שאינו מגיב לטיפולים המקובלים," אומרת פרופ' כהן-ערמון. "לאחר מכן בדקנו את השפעת המולקולות על תאים עמידים לטיפול, שנלקחו מסוגים אחרים של גידולים ממאירים בבני אדם – סרטן השחלה, סרטן המעי הגס, סרטן הלבלב, סוג נדיר של סרטן המוח וסרטן ריאות – וגילינו שמולקולות אלה ממיתות את כולם ביעילות רבה, בתוך 96-48 שעות. במקביל מצאנו כי ההליך אינו גורם כל נזק לתאים בריאים, וכי פגיעתו בתא הסרטני מתרחשת בשלב חלוקת התא (מיטוזה). בעקבות ממצאים אלה ביקשנו לחקור את מנגנון החיסול."
כדי לחשוף את המנגנון שבאמצעותו ממיתים נגזרות פננתרידין את התא הסרטני, סרקו החוקרים את התגובה לפננתרידין של כל החלבונים בתא הידועים כקשורים לתהליך חלוקת התא. בדרך זו הם זיהו מספר חלבונים ספציפיים, שעוברים שינוי בהשפעת הפננתרידין רק בתא הסרטני, בעוד שבתא הבריא הם אינם מגיבים אליו כלל.
מסבירה פרופ' כהן-ערמון: "בתהליך חלוקה תקין, הכרומוזומים של תא האם משתכפלים באופן מדויק, ושתי מערכות הכרומוזומים שנוצרו מסתדרות זו מול זו לרוחבו של כישור (spindle) בעל שני קטבים, שנוצר בתא האם. החלבונים שזיהינו בסריקה אחראים על בניית הכישור וסידור הכרומוזומים בעת החלוקה. בתאים סרטניים הפננתרידין משבש את פעילותם, וכתוצאה מכך נוצר בתא הסרטני כישור קטן מדולדל ומעוות עם כרומוזומים מפוזרים. כדי למנוע חלוקה לא תקינה של התא, בעקבות התקלה התא "מתאבד"-מתעורר בתא הממאיר מנגנון טבעי של מוות מהיר – שנכנס לפעולה בכל תא שאינו מתחלק באופן תקין, וכך נכחדים התאים הסרטניים ע"י הטיפול. יותר מכך: מכיוון שהפגיעה היא בשלב חלוקת התא, יעילות הטיפול עולה בתאים סרטניים המתחלקים בקצב גבוה – על פי רוב בגידולים ממאירים אלימים במיוחד."
לאחר שבחנו את המנגנון בתרביות תאים במעבדה, ביקשו החוקרים לבדוק את יעילותו בעכברים שהושתלו בהם גידולים סרטניים אנושיים. התוצאה הייתה מבטיחה: בעקבות הטיפול בפננתרידין נעצרה התפתחות הגידולים, וכעבור כשבועיים היו הגידולים בעכברים שטופלו קטנים משמעותית מהגידולים בקבוצת הבקרה שנותרה ללא טיפול.
"אנחנו מאמינים שזיהינו מנגנון חדש ויעיל במיוחד לטיפול בסרטן, שעשוי להתאים למגוון גידולים ממאירים," מסכמת פרופ' כהן-ערמון. "בכוונתנו לפתח מולקולות המשבשות את פעילות החלבונים שזיהינו, ובכך לרתום את המנגנון הטבעי של מוות מהיר בזמן חלוקת התא לחיסול תאים סרטניים אלימים. בהמשך נבחן את היתכנות המולקולות הללו לשימוש כתרופה בבני אדם."

5 תגובות
חדשות מהפכניות ונפלאות. יישר כוח גדול.
מזכיר את הבדיחה על האופן הראוי לקלל רופא כך שגם הרופא ישמח בה: ״הלואי וכולם יהיו בריאים״
חג כשר ושמח לכל עם ישראל
לפרופסור ערמון
קראתי את המאמר שוב ואני שמח שלא הבנתי אותו נכונה.
אם התאים הבריאים אינם ניפגעים אז זאת באמת התקדמות אדירה.
מנסיון עם קרוב משפחה שעבר טיפול כימותרפי, הכימותרפיה פגעה בסרטן אך גם גרמה להתפתחות זיהום בדם בגלל הפגיעה בעמידות הגופנית לחיידקים. קרוב המשפחה כמעט ולא שרד את הטיפול הכימותרפי והיו חייבים להפסיק את הכימותרפיה בסופו של דבר ועברו לניתוח כירורגי.
אשמח אם מישהו מהמחקר ייצור עימי קשר בנושא.
המייל שלי [email protected]
מדהים, יישר כח!
מהם השלבים כעת שעל הטכנולוגיה לעבור על מנת להיכנס לשימוש הציבור?
כמה זמן דבר כזה לוקח, בהנחה שהכל ילך כשורה?
יהודה סבדרמיש,
לצערי החמצת את העיקר במאמר. התאים הבריאים אינם ניזוקים בטיפול.
המנגנון הזה של תקיפת התאים המתחלקים כבר קיים כיום והוא פוגע לא רק בתא הסרטני אלא בכל תא שמתחלק בשלב הכימותרפיה. למשל כדוריות דם שתוקפות את הסרטן ולוחמות בו גם הן מתחלקות בזמן מילחמתן בסרטן ולכן מותקפות ע"י הכימותרפיה. למה הדבר דומה, לקרב שאתה לוחם ולצורך הצלחה בקרב אתה משמיד גם את כוחותיך הלוחמים.
אולי החומר הכימותרפי הנ"ל עדיף אך עדיין יש מקום לשיפור.
לילה טוב
יהודה