בריאות / פיתוח ישראלי, המשפר טכנולוגיה לחיסול תאים סרטניים מסוגים מסוימים, זכה להצלחה בניסויים ראשוניים בבעלי חיים
מרית סלוין, הארץ
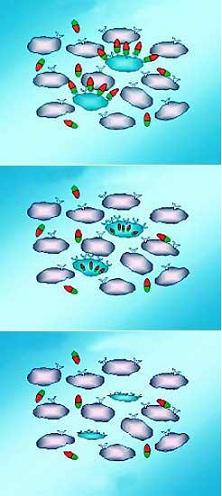
https://www.hayadan.org.il/proteinsagainstcancer.html
חלבוני הכלאיים נצמדים לקולטנים על תאי הסרטן; לאחר שנצמדו, החלבונים חודרים לתוך התאים; החלבונים פועלים בתוך התאים וגורמים למותם. מקור: בית הספר לרפואה, האוניברסיטה העברית
הגישה המנחה את חוקרי הסרטן בעשורים האחרונים היא פיתוח אמצעי ריפוי שיכוונו באופן ייחודי נגד התאים הממאירים. לשם כך יש למצוא מאפיינים ייחודיים הנמצאים בתוך תאי המטרה ולפתח מולקולות שיחסמו את פעולתם. תרופות המבוססת על עיקרון זה – המוכרת ביותר ביניהן היא "גליווק" – נכנסו לשימוש בשנים האחרונות והן נוחלות הצלחה בטיפול בסוגי סרטן מסוימים.
גישה אחרת היא לחסל את התאים באמצעות חומרי רעל שאינם מבחינים בין תא סרטני לתא נורמלי. תרופות המבוססות על גישה זו פועלות כמו טיל מונחה: הן מתבייתות על המטרה באמצעות איתור תוויות זיהוי המצויות על הקרום החיצוני של תאי הסרטן, נצמדות אל התאים ופורקות בתוכם את המטען, הגורם למות התא. כדי ליישם את הרעיון הזה יש לפתח מולקולה שתהיה מורכבת משני חלקים: חלק מכון, שיכיר את תוויות הזיהוי של התא הסרטני ויתביית עליו, וחלק הורג.
תוויות זיהוי מצויות בקרום החיצוני של כל תא נורמלי: אלה הם קולטנים הקושרים אליהם נוגדנים, הורמונים וגורמי גידול ומאפשרים להם לחדור לתוך התא. לרוע המזל, לתאים הסרטניים אין קולטנים ייחודיים המאפיינים רק אותם, שיכולים לשמש כתוויות זיהוי. עם זאת, סוגי סרטן רבים מתאפיינים בהגדלה עצומה במספרם של קולטנים מסוימים, וקולטנים אלה משמשים מטרות לתקיפה. באמצעות הנדסה גנטית אפשר לייצר חלקי חלבונים ולאחות אותם זה עם זה, כך שייווצר חלבון כלאיים שחלקו האחד מזהה את הקולטן ומתביית עליו וחלקו השני מורכב מחומר טבעי המסוגל לחסל את התא.
תרופה נגד סרטן המבוססת על גישה זו נכנסה באחרונה לשימוש רפואי. התרופה, ששמה ,Ontak היא חלבון כלאיים שהחלק המכוון שלו מורכב מגורם גידול ממקור אנושי המתביית על הקולטן, וחלקו ההורג מורכב מרעלן של חיידק הדיפטריה; התרופה משמשת לטיפול בסרטן דם מסוג מסוים.
אלא שהשימוש בחלבוני הכלאיים נתקל בבעיה. החלק ההורג שלהם, המורכב מחלבון צמחי או חיידקי שהגוף אינו מכיר, מעורר תגובת נגד של מערכת החיסון. התגובה נגד המרכיב הזר עשויה להחליש את פעולתו לאורך זמן ולגרום דלקות ופגיעה באיברים פנימיים, בעיקר בכבד. מסיבות אלה השימוש בחלבוני הכלאיים מוגבל.
פיתוח של ד"ר חיה לורברבאום-גלסקי מהמחלקה לביוכימיה של התא וגנטיקה של האדם בבית הספר לרפואה של האוניברסיטה העברית, עשוי להתגבר על הבעיה. "ההנחה שלי היתה שחלבון הכלאיים צריך להיות מורכב כולו מחלבונים שמקורם בבני אדם, כדי להתגבר על תגובת הנגד של מערכת החיסון. הרעיון היה ליצור חלבון כלאיים שבו החלק ההורג יהיה מורכב מחלבונים המצויים בגופנו באופן טבעי, המעורבים בתהליכים של מוות מתוכנת בתאים. חלבונים כאלה, כך קיוויתי, יאלצו את התא החולה להתאבד".
בכל תא מתאי הגוף מצויה מערכת הוראות המפעילה שרשרת אירועים חד-סטרית שמסתיימת במות התא. מערכת ההתאבדות הזאת, הקרויה אפופטוזיס, מורכבת ביותר. בשרשרת המובילה למות התא משתתפים חלבונים שנכנסים לפעולה בנקודות קבועות: בתחילת השרשרת, באמצעה ובסופה. "המוציאים לפועל" של התהליך הם אנזימים מיוחדים, המפרקים את חלבוני התא ואת החומר הגנטי שלו. כל אחד מהם יכול לשמש כלי הרג יעיל.
לורברבאום-גלסקי החלה לפ-תח חלבוני כלאיים בסוף שנות ה- .80"קראתי מאמר שבו נכתב כי סרטן השחלה מגיב להורמון חלבוני בשם ,GnRH וחשבתי שההורמון הזה עשוי להתאים לחלק המכוון של חלבון כלאיים", היא אומרת. "הינדסנו במעבדה חלבון בעל שני ראשים: האחד מורכב מ-GnRH והשני מורכב מרעלן של חיידק. כשהפעלנו את חלבון הכלאיים הזה על תאי סרטן מצאנו להפתעתנו שהוא מסוגל להיכנס למגוון רחב שלהם, גם לתאים שאינם קשורים למערכת הרבייה הנשית".
השלב הבא היה לבדוק אם אפשר לאלץ את התא הסרטני להתאבד. לפני כשלוש שנים יצר צוותה של לורברבאום-גלסקי חלבון כלאיים, שחלקו המכוון מורכב מהחלבון GnRH וחלקו ההורג מורכב מחלבון אנושי המשתתף בשלב האחרון של שרשרת האירועים המובילה למות התא; תפקידו בתהליך הוא לחתוך ד-נ-א.
חלבון הכלאיים החדש נבדק בתאי סרטן בתרבית. "בדקנו תרביות תאים מסוגי סרטן שונים, כולם סרטנים מוצקים השולחים גרורות. חלבון הכלאיים שלנו, כך התברר, גרם למוות של כל אותם סוגי סרטן. ניסינו גם חלבוני כלאיים המורכבים מחלבונים משרי אפופטוזיס שונים. כל החלבונים הללו הוכיחו מידה דומה של יעילות בהרג תאי המטרה. בכל המקרים נוכחנו בתבנית דומה של הרג 'שקט' של התאים הממאירים".
בשלב הבא בדקו חברי הצוות את חלבון הכלאיים בבעלי חיים. הם הזריקו את החומר לעכברים שבגופם היה גידול סרטני של המעי הגס, שמקורו בבני אדם. לעכברי ביקורת הוזרק רק החלק המכוון של חלבון הכלאיים, ולקבוצת ביקורת נוספת לא הוזרק החלבון כלל. הטיפול ניתן במשך עשרה ימים, והתוצאות הראו כי ביותר מ-%90 מהחיות שנשאו את הגידול, נסוג הגידול לחלוטין. המחקר התפרסם לפני כחודשיים בכתב העת "Clinical Cancer ."Research
"התוצאות הראו שהחלבון האנושי שהוספנו לחלק ההורג של המולקולה נכנס ביעילות לגרעין וחתך את מולקולות הד-נ-א", אומרת לורברבאום-גלסקי. "זה מראה לנו שהתא, בזכות העובדה שהכיר את החלבון, כיוון אותו למקום הנכון". לדבריה, "הטכנולוגיה הזאת ישימה במגוון עצום של מחלות, בתנאי שנדע לכוון בצורה יעילה את חלבון הכלאיים לתא המעורב במחלה". צוותה שוקד עתה על יישום הרעיון במקרים של מחלות דלקתיות, דחיית שתלים ואלרגיות. לפני שנה הקימה לורברבאום-גלסקי את חברת ,Target-In בשיתוף חברת יישום של האוניברסיטה העברית.
ריכוז ידעני מדעי החיים והרפואה
"וירוס חכם" הצליח לחסל תאי סרטן במוח – פגע רק בתאים החולים
ידען חידושים ברפואה
https://www.hayadan.org.il/BuildaGate4/general2/data_card.php?Cat=~~~528523970~~~178&SiteName=hayadan
