ניוון של תאי מערכת החיסון במוח עשוי להיות הגורם הביולוגי לדיכאון, וייתכן שקיימים חומרים שיכולים לשקם את התאים האלה – ולהיות נוגדי דיכאון
דיכאון הוא אחד הגורמים הראשיים לסבל אנושי וחוסר תפקוד ומוביל לרוב ההתאבדויות. תסמיניו כוללים מצב רוח ירוד, אובדן הנאה ועניין (למשל בפעילות חברתית), תחושות של חוסר ערך, אשמה וחרטה, חוסר אונים, ייאוש ושנאה עצמית, עייפות ואדישות.
במעבדה לפסיכו-נוירו-אימונולוגיה באוניברסיטה העברית, שמנהל מדען המוח פרופ’ רז ירמיה, מנסים לגלות מנגנונים ביולוגיים חדשים של דיכאון כדי לפתח על בסיסם תרופות חדשות ויעילות יותר. פרופ’ ירמיה: “הגורם הביולוגי הראשוני לדיכאון עדיין לא ידוע, ולכן התרופות הקיימות לא מסייעות לחולים רבים, או שנדרש להן זמן רב כדי להשפיע. אחת הסיבות לכך היא שרוב המחקר על המחלה מתמקד בבעיות תפקוד של תאי עצב (נוירונים) ולא בוחן מעורבות של תאים נוספים. אנחנו וחוקרים נוספים שינינו כיוון וגילינו כי דיכאון יכול להיגרם משיבושים במערכת החיסון, ובעיקר בנציגיה במוח – תאי המיקרוגליה”.
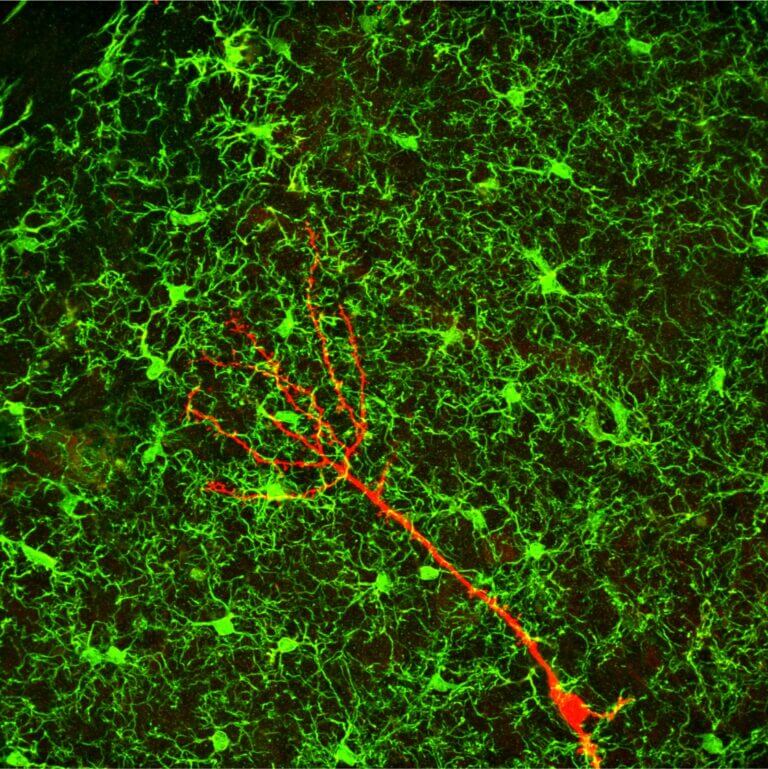
מיקרוגליה הם תאים של מערכת החיסון שחודרים למוח בתקופה העוברית, נשארים בו כדי להגן עליו מפני פתוגנים כגון וירוסים וחיידקים ומפני מחלות נוירולוגיות. בנוסף יש להם תפקידים פיזיולוגיים רבים במוח, למשל יצירה והכוונה של קשרים בין נוירונים בהתפתחות המוח ויצירת נוירונים חדשים (נוירוגנזה) בהיפוקמפוס (אזור מוחי שחיוני לעיבוד רגשי וקוגניטיבי), וחיבורם לרשת העצבית, כלומר לנוירונים הקיימים, במוח הבוגר. לכן בעיות במבנה ובתפקוד של המיקרוגליה יפריעו ליצירת נוירונים חדשים ולתפקודם ברשת העצבית ועלולות להוביל למחלות נפשיות כמו דיכאון ולמחלות נוירולוגיות כמו אלצהיימר.
פרופ’ ירמיה וצוותו ביקשו לבחון אם שינויים במבנה ובתפקוד של המיקרוגליה מובילים לדיכאון ואת מעורבותם של תאים אלו במנגנון הפעולה של טיפול אנטי-דיכאוני (הלם חשמלי). לשם כך יצרו מצב דמוי דיכאון בעכברים – וחשפו אותם לגירויי לחץ בלתי נשלטים ולא צפויים, כגון הטיית הכלוב ב-45 מעלות, אור מהבהב, רעשי רדיו, תאורה במשך כל הלילה וריח של טורף (חולדות). כל גירוי שכזה נמשך בין כמה דקות לשעה-שעתיים והופיע יום-יום באקראי במשך חמישה שבועות. לאחר מכן ראו החוקרים שהעכברים איבדו עניין והנאה מפעילויות שאמורות לגרום לכך, כגון שתיית תמיסות מתוקות, משחק חברתי, חיזור והתנהגות מינית, וכי הם פיתחו ייאוש. עכברים אלה הושוו לעכברים שלא נחשפו לגירויי הלחץ המתמשך (קבוצת ביקורת) אשר המשיכו ליהנות מהפעילויות הללו ולהשתתף בהן.
לחץ מתמשך גרם לשינויים במיקרוגליה שהובילו לדיכאון
החוקרים בחנו את מוחותיהם של עכברי הניסוי, ומצאו שמבנה ותפקוד המיקרוגליה השתנה דרמטית – בימי החשיפה הראשונים הם פעלו ביתר ולאחר כמה שבועות התכווצו והתנוונו או אפילו מתו ונעלמו. כלומר, נמצא כי לחץ מתמשך גרם לשינויים במיקרוגליה שהובילו לדיכאון.
בניסוי נוסף ביקשו החוקרים להוכיח שהשינויים במיקרוגליה עקב הלחץ המתמשך הם הגורם להתפתחות דיכאון. לשם כך הזריקו לעכברים המדוכאים חומרים שממריצים את מערכת החיסון שכיום משמשים לריפוי סרטן, ונמצא במבדקים ההתנהגותיים כי הם תרמו להעלמת תסמיני הדיכאון (העכברים חזרו להשתתף בפעילויות ונהנו מהן על אף גירויי הלחץ). בסיום נמצא שהחומרים אכן שיקמו את המיקרוגליה ואוששו את תפקודם – הם שבו לייצר נוירונים חדשים. כלומר, התגלה טיפול פוטנציאלי נוגד דיכאון.
בעקבות ממצאים אלה ביקשו החוקרים לבדוק אם גם הלם חשמלי – הטיפול היעיל ביותר לדיכאון חמור שעדיין לא ברור מהו המנגנון שעומד בבסיסו – משפיע על המיקרוגליה. לשם כך חקרו עכברים מדוכאים – לחלקם נתנו הלם חשמלי (קבוצת הניסוי) ולחלקם לא (קבוצת הביקורת). במבדקים ההתנהגותיים נמצא שהטיפול אכן הפחית את תסמיני הדיכאון (הם השתתפו בפעילויות ונהנו מהן). בבחינת מוחם התגלה כי מבנה המיקרוגליה השתקם וכי גדל מספר הנוירונים החדשים שנוצרו. בקבוצת עכברים נוספת, שבה נמנעה השפעת ההלם החשמלי על המיקרוגליה (באמצעות הזרקת חומר שמונע שינויים בהם) – הדיכאון לא חלף ומספר הנוירונים החדשים לא גדל.
בהמשך לכך ביקשו החוקרים לבדוק מהו המנגנון בהלם החשמלי שמשקם את המיקרוגליה. לשם כך בחנו בשיטות גנטיות (ריצוף רנ”א) אילו גנים משתנים בתגובה אליו. נמצא כי אצל עכברים מדוכאים שנחשפו ללחץ מתמשך ולא טופלו בשוק חשמלי – רמת הגן LAG3 במיקרוגליה עלתה, בעוד שבעכברים שנחשפו ללחץ מתמשך וטופלו בהלם חשמלי, היא ירדה והייתה תקינה. גן זה הוא חלק ממערכת בקרה של מערכת החיסון, שמווסתות את פעילותה. כשרמתו עולה – תפקוד המיקרוגליה נפגע. כדי לבדוק את מעורבות LAG3 בהשפעה נוגדת הדיכאון, הוזרק לקבוצה של עכברים מדוכאים נוגדן שחוסם את הפעילות שלLAG3 ולקבוצה נוספת הוזרקה התרופה נוגדת הדיכאון ציפרלקס. נמצא כי הנוגדן שיקם את מבנה המיקרוגליה, הגביר את ייצור הנוירונים החדשים והעלים את תסמיני הדיכאון טוב יותר מציפרלקס. פרופ’ ירמיה: “מצאנו כי גם נוגדן זה עשוי להיות בסיס לתרופות אנטי-דיכאוניות, וכי הוא אף עשוי להחליף את הטיפול בהלם חשמלי, שאמנם יעיל נגד דיכאון, אבל עלול לפגוע בזיכרון ובתפקודים קוגניטיביים נוספים”.
החיים עצמם:
פרופ’ רז ירמיה, בן 65, נשוי לנורית, פרופ’ לפסיכולוגיה ולשעבר המדענית הראשית של משרד החדשנות, המדע והטכנולוגיה, ואב לארבעה (“גאה בהם מאוד: הבת ד”ר לפסיכולוגיה קלינית של הילד, והבנים: דוקטורנט לספרות עברית, דוקטורנט לביולוגיה חישובית, ובוגר מאסטר בלימודי ביטחון”). בזמנו הפנוי מנגן בפסנתר ומרבה לטייל בעולם.
