חוקרים יצרו הרכב של ננו-חלקיקים שהצליח להשמיד תאי לימפומה בעכברים
כיצד ומדוע תאים משמידים את עצמם? אפופטוזיס הוא תהליך שבו תא פתולוגי ממית את עצמו באופן מתוכנן. תהליך מורכב זה מתרחש בכל תא בגוף וקיימים שני מנגנונים להפעלתו: דרך קולטני מוות שנמצאים על ממברנת התא או דרך המיטוכונדריה (אברון תוך-תאי שמייצר חלק ניכר מהאנרגיה הכימית שדרושה לתאי הגוף, לתפקודם ותחזוקתם). כל אחד מהמנגנונים הללו גורם להפעלת קספאזות – אנזימים שמוציאים את האפופטוזיס לפועל. מערכת זו מבוקרת היטב על ידי חלבונים מווסתי אפופטוזיס (שמעודדים תמותת תאים או מעכבים אותה). בתאים סרטניים רבים גוברת פעילות של חלבונים מעכבי תמותה, מה שמקנה להם יתרון וגורם לעמידותם לכימותרפיה.
חוקרים מבית החולים הדסה עין כרם ומהפקולטה לרפואה באוניברסיטה העברית – פרופ’ דינה בן-יהודה, פרופ’ שמעון בניטה, ד”ר טאהר נסאר, ד”ר ריקי פרלמן וד”ר איהאב עבד אלרחמן – בוחנים במחקריהם כיצד תאים סרטניים לומדים לחמוק מאפופטוזיס וכך תורמים להתפתחות גידולים ממאירים.
מה השאלה? כיצד ניתן לטפל בתאים הסרטניים בלימפומה מבלי לפגוע בתאים הבריאים?
“אחת המחלות הממאירות שאנחנו חוקרים, אשר מתפתחת בשל עיכוב אפופטוזיס, היא לימפומה. חוסר תמותת תאי הלימפומה הוא הגורם העיקרי להתפתחות אטית של המחלה. ותאי הלימפומה עמידים לכימותרפיה כיוון שהיא מכוונת לפגיעה בהתחלקותם המהירה ולא ליצירת אפופטוזיס. לפיכך ביקשנו להבין מדוע תאי הלימפומה לא מתים, מהו המנגנון שמאפשר להם זאת”, מסבירה פרופ’ בן-יהודה.
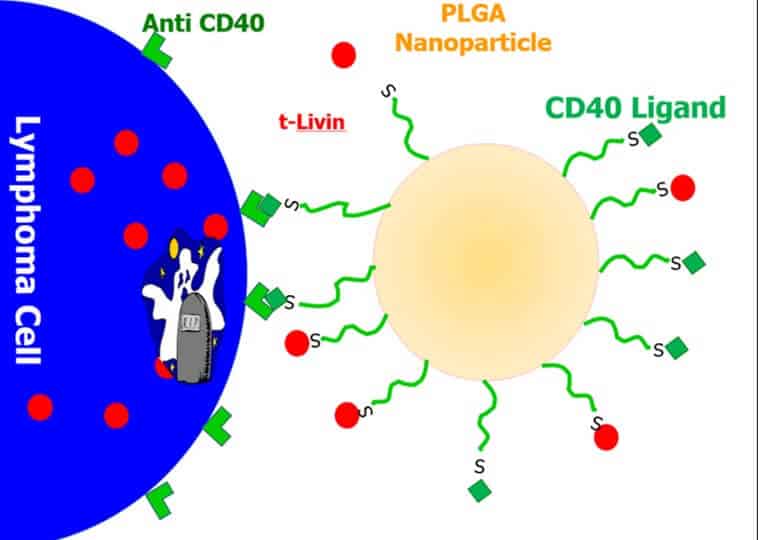
החוקרים גילו כי אחד החלבונים שמעכב את תמותת תאי הלימפומה ותאי גידול נוספים, באמצעות עיכוב קספאזות, עוזר לתאים לשרוד ומסייע לגידולים להתפתח, הוא חלבון בשם Livin (אשר משתייך למשפחת חלבונים ידועה ששמה IAP –Inhibitor of Apoptosis Proteins). לדברי פרופ’ בן-יהודה, “הבנו שיש יחסי גומלין בין הקספאזות לחלבון Livin; חלבון זה מעכב תמותת תאים, אבל בתנאים מסוימים – למשל בתאים מזוהמים או בעלי מוטציה שצריכים למות – הקספאזות חותכות את Livin ומייצרות ממנו חלבון חדש וקטן שלא רק שלא מעכב אפופטוזיס אלא אף משרה אותו, ששמו tLivin”.
בהמשך לגילוי זה החליטו החוקרים להתמקד ב-tLivin; הם בחנו אותו בעשרות תאים סרטניים (במבחנות, בעכברים ובגידולים אנושיים) שעמידים לכימותרפיה, וגילו כי הוא מעודד תמותה אינטנסיבית.
כדי להוביל את tLivin אל תאים סרטניים, במחקרם האחרון, שזכה במענק מהקרן הלאומית למדע, חברו צוותי המחקר של פרופ’ בן-יהודה מהדסה עין כרם ושל פרופ’ בניטה מהאוניברסיטה העברית ויצרו במעבדתו של פרופ’ בניטה ננו-חלקיקים שנושאים את tLivin ובנוסף את מולקולת החלבון CD40 כטיפול אפשרי ללימפומה. המולקולה ל-CD40 נבחרה שכן לתאי לימפומה יש קולטנים לחלבון זה. לאחר מכן הזריקו את התצמיד הזה לעכברים חולי לימפומה וגילו את יעילותו.
“הטיפול נמצא יעיל נגד תאי הלימפומה והאריך משמעותית את הישרדות העכברים. בנוסף הוא התגלה כטיפול פוטנציאלי ללימפומה שמערבת את מערכת העצבים (שכימותרפיה מוגבלת בטיפולה). זאת לעומת עכברים חולי לימפומה שלא טופלו ומתו בתוך זמן קצר ולעומת עכברים שטופלו בתרופה כימותרפית (דוקסורוביצין), אשר הצליחה להשמיד את תאי הלימפומה אך הייתה בעלת רעילות”, מסביר ד”ר עבד אלרחמן.
פיתחנו מערכת אספקת תרופות משולבת עם חלבונים פעילים שיכולה לטפל בסרטן מפושט ועמיד לכימותרפיה. חלקיקי הננו תוכננו ונרקחו כדי להעביר תרופות ישירות לתאים הסרטניים.
לדברי פרופ’ בניטה, “המטרה במחקר זה הייתה למקד את tLivin בתאים הסרטניים מבלי לפגוע בתאים הבריאים. לפיכך השתמשנו בננוטכנולוגיה ויצרנו הרכב של tLivin וליגנד של CD40 שהצליח להתביית רק על התאים הסרטניים שמבטאים ביתר את הקולטנים ל-CD40. כך למעשה פיתחנו טיפול אפשרי ללימפומה שהיא סוג של סרטן הדם. אנו מקווים שטיפולים המשלבים tLivinוליגנד של CD40, עם או בלי כימותרפיה, כלואים בננוחלקיקים ייבחנו בניסויים קליניים בהמשך ויהיו חלק מננו-רפואה מותאמת אישית לסרטן”.
לדברי ד”ר נסאר, “למעשה פיתחנו מערכת אספקת תרופות משולבת עם חלבונים פעילים שיכולה לטפל בסרטן מפושט ועמיד לכימותרפיה. חלקיקי הננו תוכננו ונרקחו כדי להעביר תרופות ישירות לתאים הסרטניים. דיוק זה משפר את היעילות ומפחית תופעות לוואי. בנוסף, ננו-חלקיקים יכולים לשחרר תרופות בהדרגה וכך מאפשרים טיפול מותאם אישית בסרטן עם תוצאות משופרות”.
החיים עצמם:
- פרופ’ דינה בן-יהודה, רופאה מומחית להמטולוגיה, מכהנת כפרופסור בקתדרה להמטולוגיה בפקולטה לרפואה של האוניברסיטה העברית ומנהלת המערך ההמטולוגי במרכז הרפואי הדסה. עד לאחרונה כיהנה גם כדיקנית הפקולטה לרפואה באוניברסיטה העברית.
- פרופ’ שמעון בניטה, השלים את התואר הראשון, השני והדוקטורט בבית הספר לרוקחות של האוניברסיטה העברית ואף ניהל אותו. יצא לגמלאות ב-2016 (“אני בפנסיה מדומה; מנהל מעבדה פעילה וסטארט-אפ משותף עם יישום – החברה לפיתוח המחקר של האוניברסיטה העברית”). מחקרו מתמקד בצורות מתן תרופות מבוססות ננוטכנולוגיה, מיקרו-חלקיקים ושומנים. במהלך הקריירה האקדמית שלו פרסם יותר מ-163 מאמרים ופרקים בספרים מדעיים, ערך שלושה ספרים והנפיק 40 בקשות פטנטים ופטנטים.
- ד”ר ריקי פרלמן, השלימה תואר ראשון, שני ושלישי באוניברסיטה העברית והשתלמות בתר-דוקטורט במכון הטכנולוגי של מסצ’וסטס MIT)). מנהלת את קבוצת המחקר של פרופ’ בן-יהודה ואת המעבדה ההמטולוגית בבית החולים הדסה עין כרם.
- ד“ר איהאב עבד אלרחמן, השלים תואר ראשון באוניברסיטת בן גוריון ותואר שני ודוקטורט במחלקה לגנטיקה של האדם בבית הספר לרפואה של האוניברסיטה העברית. ניהל פרויקטים במעבדה של פרופ’ בן-יהודה וכיום מנהל היחידה הארצית לעריכה גנטית בבעלי חיים.
- ד״ר טאהר נסאר, השלים תואר ראשון פעמיים (כימיה ורוקחות), תואר שני ודוקטורט בבית הספר לרוקחות של האוניברסיטה העברית. כיום חוקר עמית ובכיר במחלקה לרוקחות, מנהל מעבדת מחקר ויזם בחברות הזנק בארץ בתחום הפארמה, בעיקר פיתוח ננו-טכנולוגיה וסינתזה של תרופות בתחום הסרטן, מחלות דלקתיות והשמנת יתר. פרסם מעל 62 מאמרים מדעיים ו-32 בקשות פטנטים ופטנטים.
עוד בנושא באתר הידען:
