הקטלניות של טפיל המלריה טמונה לא רק בעוצמת המתקפה שלו על הגוף, אלא גם ברכות שלה
תאי דם אדומים הם קו החמצן של גופנו, אך הם גם בית מחסה מושלם לאחד היצורים הקטלניים ביותר: טפיל המלריה. כשבועיים לאחר חדירתו לגוף, מנחית הטפיל פלסמודיום פלציפרום מתקפה-רבתי: הוא משתלט במהירות על מספר עצום של תאי דם אדומים ומתרבה בתוכם. בשלב זה הופכת המחלה למסכנת חיים, ולראיה – מדי יום מתים ממנה כאלף ילדים ברחבי העולם. שתי קבוצות מחקר במכון ויצמן למדע חברו יחד כדי לגלות מה הופך את פלישתו של טפיל המלריה ליעילה כל כך – וגילו כי הסוד טמון לא רק בעוצמת המתקפה אלא גם ברכות שלה.
ד"ר נטע רגב-רוצקי וחברי קבוצתה במחלקה למדעים ביומולקולריים גילו כי בועיות זעירות שמפריש הטפיל בגופנו מכילות מטען מפתיע: פרוטאזום – מכונה מולקולרית אשר מפרקת חלבונים פגומים או מיותרים. עמיתתה למחלקה, פרופ' מיכל שרון, מתמחה בחקר פרוטאזומים. כדי לחשוף מה מעשיהם של הפרואטזומים בבועיות המלריה, חברו שתי קבוצות המחקר יחד, בהובלת תלמידת המחקר אליה דקל ממעבדתה של ד"ר רגב-רוצקי והחוקרת הבתר-דוקטוריאלית ד"ר דנה יפה ממעבדתה של פרופ' שרון, וחשפו כיצד נעזר טפיל המלריה בפרוטאזום כדי להכשיר את הקרקע לפלישה הגדולה.
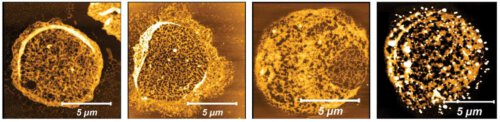
הטפיל מנצל את הגמישות של תאי הדם האדומים
לתאי דם אדומים תכונות ייחודיות ההופכות אותם למארחים מזמינים במיוחד לטפיל המלריה. ראשית, בתהליך התמיינותם, הם מאבדים את רוב איברוני התא, ובכך מאבדים את יכולתם להתגונן מפני גורמים מזיקים ובהם טפילים. בנוסף, מכיוון שמתוקף תפקידם הם מוכרחים להגיע לנימי הדם הדקים ביותר כדי לספק חמצן לכל רקמות הגוף, יש להם יכולת מבנית אדירה להתגמשות; את היכולת הזו בדיוק, מתברר כעת, מנצל הטפיל לטובתו.
לאחר שחדר לגוף האדם, מבלה פלסמודיום פלציפרום כשבועיים בכבד, שם הוא עובר שינויים ומתרבה. לאחר מכן הוא חודר למחזור הדם ופולש לתאי דם אדומים בוגרים, ובמקביל שולח לשכניהם חיל חלוץ: בועיות הנושאות את הפרוטאזומים שמטרתם לרכך את התאים האלה כדי להקל על החדירה לתוכם. צעד הכנתי זה מאפשר לאלפי טפילים לפלוש לכמות אדירה של תאי דם אדומים בתוך שניות.
החוקרות חשפו כיצד בדיוק מתבצעת הכשרת הקרקע לפלישה: הן גילו כי הבועיות שמפריש טפיל המלריה מכילות את גרסת הפרוטאזום המכונה S20, שהיא קטנה יותר וזקוקה לפחות אנרגיה מאשר גרסאות אחרות. בשיתוף עם ד"ר אירית גולדיאן וד"ר סידני כהן מהמחלקה לתשתיות למחקר כימי, פיתח צוות המחקר שיטת דימות המבוססת על מיקרוסקופיית כוח אטומי וחשף כי הפרוטאזום מנקב חורים בשלד של תאי הדם האדומים ומפרק סיבי חלבונים בקרומיהם; המדענים זיהו ארבעה חלבוני מטרה של תאי דם אדומים שאותם מפרק הפרוטאזום. בנוסף, בשיתוף פעולה עם ד"ר עידו עוזרי מהמחלקה לתשתיות מחקר מדעי החיים הם פיתחו אלגוריתם של בינה מלאכותית המסוגל לזהות שלדים תאיים שרוככו באמצעות S20.
הקשר בין הפרוטואזום וסרטן
כדי לוודא שהפרוטאזום הוא אכן האחראי לפעולת הריכוך, חסמו המדענים את האתר הפעיל שלו. חסימה זו מנעה את ריכוך התאים, ובהתאם הגבילה מאוד את יכולת הפלישה של הטפיל לתוכם ואת התרבותו. ממצא זה פותח כיוון חדש לפיתוח תרופות נגד מלריה שיתמקדו בחסימת הפרוטאזומים של הטפיל. הממצאים עשויים להיות רלוונטיים גם למחלות זיהומיות נוספות, שכן רכיבים של S20 נמצאו גם בבועיות שמפרישים טפילים אחרים, למשל, אלה הגורמים למחלת השינה ולשושנת יריחו. יתירה מכך, מחקר זה עשוי לשפוך אור חדש על מחלת הסרטן, שכן תת-ייחידות של הפרוטאזום S20 התגלו באחרונה גם בבועיות זעירות שמפרישים תאים מעודדי סרטן בגופנו.

במחקר השתתפו גם ד"ר גילי בן-ניסן, ד"ר יפעת אופיר-בירין, ד"ר מתיה מורנדי, יעל אוחנה דניאל, פולה אבו כרם, דניאל אלפנדרי, שימרית מליחי, טל בלוק טמין, ד"ר אור-ים רווח, אריאל רודיק וד"ר אורי אבינועם מהמחלקה למדעיים ביומולקולריים; ד"ר רון רוטקופף וד"ר זיו פורת מהמחלקה לתשתיות מחקר מדעי החיים; דבקשי מוליק ופרופ' ניר גוב מהמחלקה לפיסיקה כימית וביולוגית; ד"ר תמר זיו מהטכניון; ד"ר צ'אבייר סיסקוולה, ד"ר מתיו פימנטל, ד"ר תומס נבל וד"ר יוג'ין קאפ מאוניברסיטת מלבורן ומכון וולטר ואליזה הול למחקר רפואי; ג'וליה ברגמאשי ופרופ' חייס ווייט מהאוניברסיטה החופשית של אמסטרדם; ד"ר רעיה סורקין מאוניברסיטת תל אביב; וד"ר תרזה קרבלהו מאוניברסיטת לה טרוב שבמלבורן.
עוד בנושא באתר הידען:
