מדעני מכון ויצמן למדע פיתחו גישה חדשה לאימונותרפיה המבוססת על תקשורת בין תאי המערכת החיסונית
כדי להשיג תוצאות בשדה הקרב נדרש שילוב כוחות של מודיעין מדויק ולוחמים נחושים. אלא שבסביבת הגידול הסרטני הלוחמים של המערכת החיסונית – תאי T – מאבדים מהר מאוד את יכולת ההרג שלהם ונעשים מותשים, בעוד המעטפת המודיעינית של התאים הדנדריטיים מועטה. זו אחת הסיבות לכך שההבטחה הגדולה של האימונותרפיה – דור הטיפולים החדש הרותם את המערכת החיסונית למלחמה בסרטן – אינה מתממשת במלואה. במחקר חדש, המתפרסם היום בכתב-העת המדעי Cell, מציגים מדעני מכון ויצמן למדע נוגדן שפיתחו המחבר בין תאי T ותאים דנדריטיים ליצירת תגובה חיסונית עוצמתית כנגד סרטן. המחקר פותח צוהר לגישה חדשה באימונותרפיה: פיתוח טיפולים המחברים בין תאים שונים של המערכת החיסונית להרכבת צוות קרב יעיל נגד סרטן ומחלות אחרות.
אחד הטיפולים האימונותרפיים שמובילים את מהפכת הטיפול הביולוגי בסרטן בעשור האחרון, עושה שימוש בנוגדנים החוסמים את PD-1 – קולטן בקרה (checkpoint) המצוי על פני השטח של תאי T. כאשר קולטן זה מתבטא בתאי T, חלבון בסביבת הגידול עלול להיקשר אליו ולהעביר את תאי T למצב המכונה "תשישות". נוגדי PD-1 מונעים מהחלבון להיקשר לתאי T ולדכאם, אבל חלק גדול מהחולים כלל אינם מגיבים לטיפול זה – וברבים אחרים יעילותו קצובה בזמן.
על מנת לפתח אימונותרפיה יעילה יותר, בדקו מדענים ממעבדותיהם של ד"ר רוני דהן ופרופ' עידו עמית במחלקה לאימונולוגיה מערכתית במכון, היכן נכשל הטיפול הקיים. לשם כך הם דגמו תאי T ממודל עכבר של שני סוגי סרטן שטופלו בנוגדי PD-1. "בחנו באמצעות טכנולוגיות מתקדמות של ריצוף אר-אן-אי ברמת התא הבודד ואלגוריתמים של ביג דאטה כמעט 130 אלף תאי T שחלקם הגיבו לטיפול וחלקם לא", מתאר פרופ' עמית. "באופן מפתיע, קבוצת תאי ה-T שכן הגיבה לטיפול ביטאה גנים שמעידים על אינטראקציה עם אוכלוסייה נדירה של תאים דנדריטיים".
תאים דנדריטיים הם מציגי אנטיגנים מקצועיים, כלומר הם אוספים מודיעין ברחבי הגוף באמצעות בליעת מולקולות השייכות למחוללי מחלה, ומציגים את הממצאים לתאי T במטרה להתריע בפניהם על פולש זר או התמרה סרטנית, ולהניע אותם לפעולה. הטיפול בנוגדי PD-1 כשלעצמו אמור לסייע בהפעלת תאי T שנלחמים בגידולים סרטניים, אך כשבחנו מודל סרטן של עכבר ללא תאים דנדריטיים, ראו החוקרים שהטיפול מאבד לגמרי את יעילותו. במלים אחרות, הם זיהו כי התאים הדנדריטיים חיוניים להתרבות ולהפעלה של תאי T ספציפיים כנגד הסרטן, ולפיכך נחוצים להצלחת הטיפול כולו.
גילויים אלה חשפו חולשה מרכזית של הטיפולים הקיימים, שכן אוכלוסיית התאים הדנדריטיים נדירה למדי ברבים מהגידולים וברוב החולים שמקבלים כיום את הטיפול בנוגדי PD-1. במצב זה, ישנה הסתברות נמוכה למפגש בין תאים אלה ובין תאי ה-T שהם מפעילים. הבנה זו סללה את הדרך להנדסת נוגדן חדש בשם BiCE (קיצור של Bispecific DC-T Cell Engager) ששתי זרועותיו תוכננו לקשר בין שני תאים שונים – אחת קושרת תא T וחוסמת את קולטן PD-1, בדומה לטיפולים הקיימים, בעוד השנייה מגייסת תא דנדריטי מהאוכלוסייה הנדירה שחיונית להפעלת תאי T. מי שהובילו את חקר הטיפול החדש הם תלמידי המחקר לדוקטורט יובל שפיר איתי ממעבדתו של ד"ר דהן, ואורן ברבוי, ממעבדתו של פרופ' עמית.
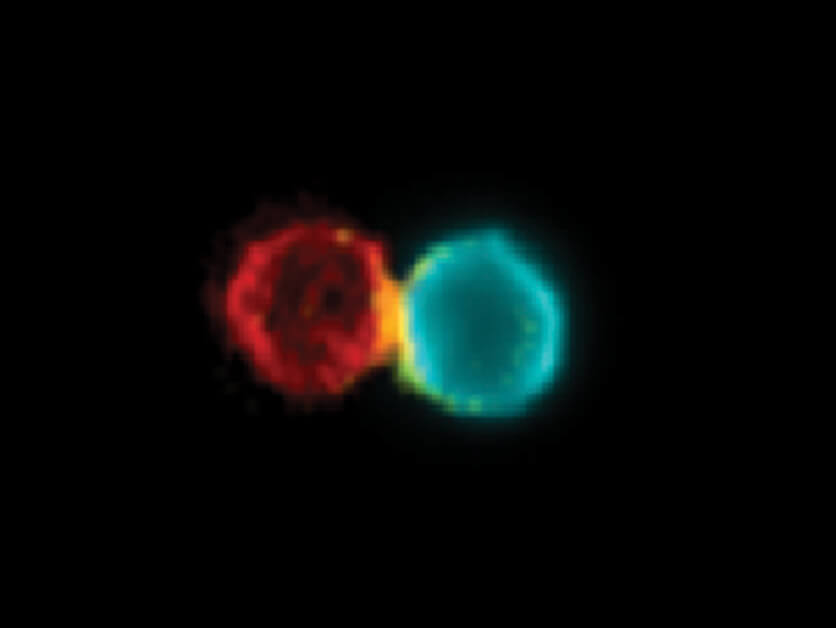
לאחר שפיתחו את הנוגדן, בחנו המדענים את אופן פעולתו. כשסימנו פלואורסצנטית את הנוגדן ואת תאי החיסון של עכברים עם סרטן עור שקיבלו את הטיפול החדש, התמונה שהתקבלה הראתה בבירור כיצד הנוגדן מחבר פיזית בין תא T לתא דנדריטי ומעלה את כמות הצמדים של תאים אלה בסביבת הגידול ובקשרי הלימפה הצמודים לו. עוד התגלה כי הצמדים שנוצרו על-ידי הנוגדן היו פעילים ויצרו תגובה חיסונית נגד הגידול. יתירה מכך, בעקבות הטיפול, תאים דנדריטיים ששהו בסביבת הגידול הסרטני, היגרו אל קשרי הלימפה וחברו לתאי T הנמצאים שם על מנת לחלוק עמם את המידע המודיעיני ולהפעילם.
תקווה לטיפול במחלות חשוכות מרפא
יעילות הטיפול החדש נבדקה במחקר על כמה מודלים עכבריים הכוללים סרטן אגרסיבי בשד, בריאות ובעור. קצב גידול סרטני העור והריאות ירד משמעותית עם הטיפול בנוגדן החדש, לעומת הטיפול הקיים. מנגד, סרטן שד שאינו מגיב לטיפול הקיים גם לא הגיב לנוגדן החדש. החוקרים שיערו שהסיבה לכך היא מספרם הנמוך מאוד של תאים דנדריטיים פעילים בסביבת גידול זה. לכן, הם ניסו טיפול משולב בנוגדן החדש שפיתחו, יחד עם טיפול מוכר המעלה את רמת הפעילות של תאים דנדריטיים בסביבת הגידול. הטיפול המשולב נמצא כיעיל מהאפשרויות הקיימות והראה שגם בסוגי סרטן שלא הגיבו עד כה לאימונותרפיה, סינרגיה בין תאי T ובין תאים דנדריטיים פעילים יוצרת תגובה חיסונית חזקה נגד הגידול.
בשלב הבא, בדקו המדענים האם לצד תגובה חיסונית חזקה, מצליח הנוגדן החדש למנוע מהמחלה לשוב בעתיד. ברבים מחולי הסרטן ישנה הישנות של המחלה, גם לאחר שהוסר הגידול המרכזי וטופלו הגרורות הידועות. הסיכון המשמעותי ביותר שמטריד את רוב החולים הוא גרורות זעירות החומקות מתחת לרדאר ומתפתחות לאחר זמן למחלת סרטן מחודשת. BiCE, בניגוד לטיפול הקיים, נמצא במחקר כיעיל גם נגד התפתחות גרורות בריאה לאחר הסרת הגידול המרכזי. החוקרים משערים כי זוהי עדות לכך שהנוגדן מצליח לייצר תגובה חיסונית מערכתית בכל הגוף נגד הסרטן, ואף להשאיר לאחר הטיפול תאי חיסון שזוכרים כיצד לזהות את הסרטן ולהגיב נגדו.
חברת "ידע" האחראית על מסחור הקניין הרוחני של מדעני מכון ויצמן למדע, הגישה באחרונה בקשה לרישום פטנט על ממצאים אלה, במטרה לפתח טיפול חדשני על בסיס הנוגדן שפיתחו מדעני המכון. "אנו מציגים כאן גישה חדשה שמדגישה ראייה מערכתית של אימונותרפיה", אומר ד"ר דהן. "במקום להתרכז במסלול אחד, אנו מהנדסים נוגדנים שמשמשים פלטפורמה לתקשורת בין תאי חיסון שונים לפי בחירתנו. זו התפתחות שמעניקה תקווה לא רק לחולי סרטן, אצלם נדרשת הפעלה של מערכת החיסון נגד הגידול, אלא גם לחולים במחלות שונות, כמו למשל מחלות אוטואימוניות, שבהן החולים זקוקים לדיכוי חיסוני של התגובה נגד הגוף עצמו. שיטות כוללניות לדיכוי מערכת החיסון קיימות, אך אני מאמין שהגישה החדשנית שלנו תאפשר לדכא ולהפעיל תגובות חיסוניות ממוקדות, ללא ההשלכות הרחבות והמסוכנות של דיכוי והפעלה כלליים של מערכת החיסון".
במחקר השתתפו גם ד"ר רן סלומון, ד"ר קן שי וד"ר איתן וינטר מהמחלקה לאימונולוגיה מערכתית במכון; אחיעד ברקוביץ ופרופ' עמוס תנאי מהמחלקה למדעי המחשב ומתמטיקה שימושית במכון; תמר שאמי ופרופ' נטע ארז מבית הספר לרפואה של אוניברסיטת תל-אביב; וד"ר זיו פורת מהמחלקה לתשתיות מחקר מדעי החיים במכון.
עוד בנושא באתר הידען:
