שרון לפלר נמצא בשלבי סיום של עבודת הדוקטורט במחלקה לחקר התא ואימונולוגיה בפקולטה למדעי החיים באוניברסיטת תל-אביב. את מחקרו הוא מבצע במעבדה של פרופ’ מיגל וייל
נפגשתי עם שרון לפלר כדי לשאול אותו מה עושים שם באוניברסיטה.
שרון נמצא בשלבי סיום של עבודת הדוקטורט במחלקה לחקר התא ואימונולוגיה בפקולטה למדעי החיים באוניברסיטת תל-אביב. את מחקרו הוא מבצע במעבדה של פרופ’ מיגל וייל.
שרון, אז מה אתם עושים שם?
באופן כללי המעבדה עוסקת בנושא התפתחות עוברית, כלומר בשאלה כיצד מתפתח תא בודד (ביצית מופרית) לעובר שלם המכיל סוגים רבים ומגוונים של תאים. נושא נוסף שבו אנחנו עוסקים הוא התמיינות עצבית, כלומר התמיינות של תאי גזע עובריים לתאי עצב, וחקר מחלות הגורמות לפגיעה במערכת העצבים.
איך חוקרים מחלות מהסוג הזה?
ראשית, יש צורך במודל מחקר. כיום רוב המעבדות עוסקות במודל עכברי. הכוונה היא שמשרים בעכבר מחלה בעזרת מוטציה או טיפול תרופתי, כאשר יש לזכור שהמחלות האלה ידועות כיום רק באדם. הבעיה עם מודל זה היא שהעכבר הוא לא בדיוק אדם, והגנים שלו ‘מתנהגים’ אחרת. מצד שני, לא ניתן לחקור את המחלה ישירות בבני אדם מכיוון שלא ניתן לבדוק את תאי העצב בגופו של החולה או לגדל אותם בתרבית תאים. הפיתרון הוא שימוש בתאי גזע.
מהם תאי גזע?
הגוף שלנו מורכב מסוגי רקמות ותאים שונים מאוד אחד מהשני. תא שריר שונה מתא עצב או תא עור. זאת למרות שמקורם של כל התאים הוא מתא אחד ראשוני שנוצר מאיחוד של תא הביצית מהאם ותא זרע מהאב. תהליך ההתפתחות של העובר כולל חלוקה של התאים והתמיינות לתפקידים. תא גזע הוא תא שעוד לא התמיין ויש לו את הפוטנציאל להפוך לכל סוג תא.
איך קשורים תאי הגזע לפיתוח מודל מחקר משופר למחלות?
הצעד הראשון הוא להשיג תאי גזע עובריים נורמליים. הצעד השני הוא ללמוד כיצד לגרום לתאי הגזע להתמיין רק לסוג התאים אותם אנו מעוניינים לחקור, תאי עצב (ראו תמונה 2). במקביל, הצעד השלישי הוא להפיק, באופן דומה, קו תאי גזע מעובר מבחנה שמכיל את המוטציה.
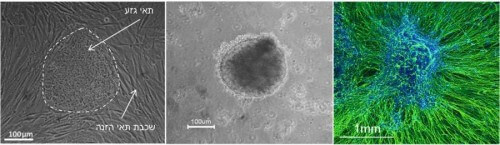
אז מהיכן מגיעים התאים האלה?
ראשית כדאי להזכיר שהמחקר בתאי גזע עובריים בעייתי מאוד במדינות רבות בעולם בגלל גישת הדת הנוצרית שגורסת שמרגע ההתעברות, ישנו יצור חי שיש להגן עליו. היהדות, לעומת זאת, אינה מחזיקה בדעה זאת. מבחינת היהדות העובר נחשב ישות רק מגיל 40 יום. זאת אחת הסיבות שאין מניעה עקרונית לעסוק במחקר בתאי גזע בישראל, בכפוף, כמובן, לועדת הלסינקי.
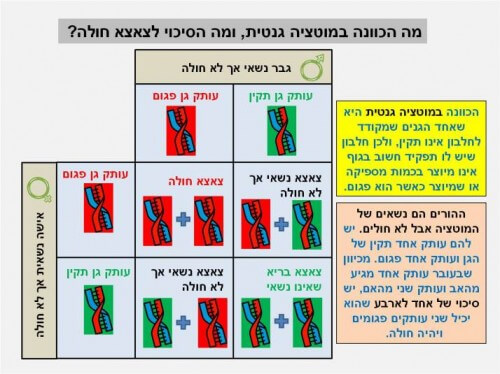
במהלך ביצוע הפריה מלאכותית, כאשר העובר מכיל רק שמונה תאים, ניתן לקחת אחד מהם למטרת בדיקה גנטית, כך ששבעת התאים הנותרים יוכלו להמשיך ולהתפתח בצורה בריאה.
כאשר שני הורים הם נשאים של מוטציה גנטית הקשורה למחלה קשה (לדוגמא סיסטיק פיברוזיס), חייבים ההורים לבצע הפריה מלאכותית, כדי לוודא שהעובר בריא. ניתן לבדוק האם אותו תא שלקחנו מכיל שני עותקים של הגן הפגום (ראו איור 3). אם שני העותקים תקינים, שבעת התאים הנותרים יוכלו להמשיך ולהתפתח בצורה בריאה. אם שני העותקים נושאים מוטציה, לא ישתמשו בתאים הנותרים לצרכי הריון, אך ניתן להשתמש בהם לצרכי מחקר של המחלה. את תאי הגזע ניתן לגדל בצלחת, כאשר יש לבצע טיפולים מיוחדים כדי לשמור עליהם שלא יתמיינו.
איזה מחלה אתם חוקרים במעבדה?
המחלה נקראת דיסאוטונומיה משפחתית (FD – Familial Dysautonomia) והיא מופיעה בעיקר ביהודים בישראל ובארה”ב שהם יוצאי אשכנז מאזור מסוים, ולכן היא נדירה מאוד. החולים נולדים עם בעיות גם במערכת העצבים הלא רצונית שאחראית בגוף, בין היתר, על ויסות לחץ דם, ויסות חום גוף ועל עיכול, וגם במערכת העצבים הסנסורית שאחראית על קליטת גירויים מהסביבה. בעבר לא הכירו את המחלה והתינוקות החולים לא שרדו, אך כיום בסיס הידע גדול יותר ובעזרת טיפולים שונים החולים מאריכים ימים. כיום יודעים לזהות את הגן הבעייתי, אך לא יודעים מהם התפקידים של החלבון הפגום שנמצא בכל תא בגוף.
את קו תאי הגזע עם הגן הפגום הפיק פרופ’ בנימין ראובינוף מבית החולים הדסה עין כרם. בשיתוף עם המעבדה שלו פיתחנו תהליך, שאורך כחודשיים, ושבסופו התאים מתמיינים לתאי העצב שמעניינים אותנו. השימוש בתאים אלה לצורך פיתוח מודל מחקרי הוא חדש, ייחודי ופורץ דרך בקנה מידה עולמי.
בהמשך היה עלינו לחזור על התהליך עבור התאים החולים, כאשר לא היינו בטוחים האם בכלל יכולים התאים החולים להתפתח לתאי עצב. התוצאות שקיבלנו מראות שהתאים בתרבית נראים כמו תאים שמתפתחים מעובר בריא, כלומר לא מדובר בכשל מערכות מלא בהתפתחות תאי העצב. כעת אנחנו עדיין חוקרים את ההבדלים בין התאים החולים והבריאים במספר כיוונים שונים, אך בד בבד יש בידינו מערכת מודל מוכנה לשלב הבא.
מהו השלב הבא?
בימים אלה מוקם אצלנו במעבדה רובוט חדש שמבצע תהליך drug screening בעזרת מיקרוסקופ אוטומטי. אנחנו מזינים לרובוט מספר רב של חומרים והוא בודק את התגובה של תאים אליהם. הרובוט מסוגל לבדוק כמות גדולה מאוד של חומרים ולנטר אחרי מספר רב של פרמטרים במהירות שאינה אפשרית עבור חוקר אנושי. בעזרת מערכת המודל שפיתחנו נוכל למצוא בעיה בתאים החולים ואז לחפש חומר שמתקן אותה.
אנחנו יודעים, למשל, שבאנשים הלוקים בדיסאוטונומיה משפחתית יש רמה נמוכה של חלבון ה-FD, ואפילו קיים חומר ממקור צמחי שעוזר, אך הבעיה היא שהוא רעיל. בעזרת הרובוט ניתן לבדוק כמות גדולה של נגזרות של החומר על תאי המודל, בתקווה למצוא אחת יעילה ובטוחה שתעלה את רמת החלבון בתאים. תרופה כזאת תוכל למנוע התדרדרות במצב החולים, להעלות את רמת חייהם ואולי אף יותר מכך.
זה לא בעצם מה שחברות תרופות עושות?
כן, אבל יש לזכור שמדובר בדוגמא קלאסית למושג ‘מחלות יתומות’. לחברה שמטרתה רווח כלכלי אין את התמריץ להשקיע כסף וזמן רב כל כך במציאת תרופה למחלה נדירה כל כך עם מספר חולים נמוך כל כך. כמו כן, יש לזכור שמעבר למציאת תרופה למחלה, תוך כדי הניסיון להבין את ההבדלים בין נוירון בריא לחולה, אנו גם צוברים ידע ביולוגי בסיסי רב, שיכול לתרום גם להבנת מחלות עצביות אחרות.
——————————————————————
במהלך ראיון זה בחרתי לדון אך ורק בהיבט המדעי של הנושא, אך קיים גם היבט אישי. מי שמעוניין, מוזמן לצפות בתוכנית פנים אמיתיות בערוץ 10 שבה סיפר פרופ’ מיגל וייל לעיתונאי אמנון לוי את סיפורו האישי.
——————————————————————
המחקר נעשה בשיתוף ובחלקו במימון העמותה הישראלית לדיסאוטונומיה משפחתית.
* המאמר בנושא, מתוכו לקוחה תמונה 2:
* Valensi-Kurtz M1, Lefler S1, Cohen M, Aharonowiz M, Cohen-Kupiec R, Sheinin A, Ashery U, Reubinoff B, Weil M: “Enriched population of pns neurons derived from human embryonic stem cells as a platform for studying peripheral neuropathies”. PLoS One 2010;5:e9290.
————————————————-
אני אשמח להפגש ולשוחח עם כל תלמיד מחקר (אולי אתם?) שמוכן להשתתף ולספר לי קצת על מה הוא עושה (והכול במחיר של שיחה לא יותר מידי ארוכה). תוכלו ליצור איתי קשר דרך טופס יצירת קשר.
זה הזמן לספר לכולם מה אתם עושים, אולי הפעם הם גם יבינו
המאמר פורסם בבלוג של אורן שעיה “עד כדי קבוע“

תגובה אחת
התרגשתי מאוד מהכתבה של אמנון לוי בפנים אמיתיות יישר כוח .