מה הקשר בין בועות במשקה מוגז, עננים וגבישים? הפיזיקה והכימיה של ההתקבצות – נושא יום-יומי שהתיאוריה שמאחוריו אינה פשוטה.

בירה, כמו כל המשקאות המוגזים, רוויה מולקולות פחמן דו-חמצני (CO2) מומס, כלומר, מולקולות ה-CO2 מוקפות במולקולות מים שאינן מאפשרות להן להיצמד זו לזו. מעל הנוזל, לעומת זאת, ה-CO2 מצוי במצב גזי “רגיל” בלחץ של כ-2 אטמוספירות (בערך כמו הלחץ בגלגלי המכונית). בכל שבריר שנייה מקצת מולקולות ה-CO2 שבגז עוברות לנוזל, בזמן שמקצת ממולקולות משתחררות מן הנוזל לגז. אם לא נטלטל את הבקבוק לזמן מה, קצבי המעבר ישתוו, ויתקבל מצב הקרוי ‘שיווי משקל דינאמי’.
מה קורה כשפותחים את הפקק? הגז הדחוס שבאזור הפיה משתחרר החוצה בבת אחת, ובכך מוציא את המערכת משיווי משקל. כדי להגיע שוב למצב של שיווי משקל, צריכות מולקולות CO2 רבות להשתחרר מן הנוזל אל האוויר, אבל היות שאין הן יכולות להשתחרר מיידית, הן עושות זאת לאט ובסבלנות בדרך הנקראת ‘בועות’. נשים לב, שעל מנת ליצור הפרדה בין חבילת הגז (בועה) לנוזל יש להשקיע אנרגיה. מדוע? נוכל לחשוב על שתי קבוצות של אנשים (נאמר, כחולים ואדומים) המעורבבות זו בזו בצורה אחידה. אם תנועת האנשים אקראית, מועטים מאוד הסיכויים שייווצרו קבוצות הומוגניות של אנשים מסוג אחד, נאמר, אדומים. במונחים תרמודינאמיים, על מנת שזה יתרחש דרגת אי-הסדר (אנטרופיה) צריכה לרדת, ולכן זה אינו תהליך המתרחש באופן ספונטאני.
סיבה נוספת היא סיבה הקשורה בקשרים הכימיים – הבועה צריכה להרחיק את מולקולות המים אלה מאלה, לשם כך יש לשבור את הקשרים החזקים באופן יחסי שבין מולקולות המים (קשרי מימן). שתי הסיבות מדגישות שהשתחררות של גז מנוזל אינו תהליך פשוט.
בהתחשב בכך שדרושה השקעה יחסית גבוהה של אנרגיה, שאינה זמינה בדרך כלל, כיצד בכל זאת נוצרות בועות? נזכר בקבוצות האנשים המעורבבות זו בזו, ונניח שבמקומות מסוימים ישנם כרוזים שקוראים במגפונים “כל האדומים אלי!” מתקבל על הדעת, שבסביבת הכרוזים תיווצרנה קבוצות ‘אדומות’ שילכו ויגדלו. המקבילה הפיזית של הכרוזים נקראת ‘אתרי נוקליאציה’ (nucleation sites) ותהליך ההקבצה נקרא ‘התגרענות‘: חלקיקים זעירים בנוזל מהווים גרעינים שסביבם מתקבצות מולקולות גז על מנת ליצור את המשטח הראשוני שמפריד אותן מהנוזל. מרגע שנוצרה בועה זעירה (מיקרוסקופית), נחוצה כבר הרבה פחות אנרגיה ולכן התהליך מתגלגל מעצמו עד להיווצרות של בועה גדולה (מקרוסקופית) שצפה מעלה. אתרים אחרים שמשמשים אתרי התגרענות של בועות הן בועות אוויר המצויות שם מלכתחילה – למשל בסדקים קטנים בכוס. הבועה הקיימת כבר יוצר אזור שבו אין מים – הרחבת בועה קיימת דורשת הרבה פחות אנרגיה מיצירת בועה חדשה.
אגב, ישנם תהליכים רבים בטבע, שעל מנת להתחיל אותם נחוצה אנרגיה התחלתית יחסית גבוהה – סף אנרגטי הנקרא אנרגיית שפעול. תהליכים אלו לא היו יוצאים אל הפועל אלמלא אותם ‘מתווכים’ שפעולתם מקבילה לפעולתם של אתרי הנוקליאציה. למשל, אינספור תהליכים ביולוגים משופעלים על ידי אנזימים שהינם מולקולות גדולות שעל גבם ריאקציות ביוכימיות יכולות להתרחש בקלות יחסית, כמו למשל הריבוזומים של עדה יונת שעלו לגדולה. אמנם, אותם תהליכים היו מתרחשים גם ללא תיוך האנזימים, אך זה היה לוקח הרבה יותר זמן. בכימיה אותו מתווך נקרא ‘זרז’ (קטליזטור). יש תגובות שדי לספק את אנרגיית השפעול בהתחלה, בדומה לניצוץ שמתחיל את הבעירה או כפי ששר ברוס ספרינגסטין: You can’t start a fire without a spark אחר כך מספקת התגובה עצמה את האנרגיה. אבל יש תגובות שדורשות אספקת אנרגיה רציפה.
בחזרה לבירה. כפי שנאמר קודם, אתרי נוקליאציה יכולים להיות גם סדקים מיקרוסקופיים בזכוכית. בפעם הבאה שתתבוננו בכוס עם משקה מוגז, שימו שב שהבועות אינן נוצרות אקראית בכל מקום בנוזל. למעשה, ישנן שרשראות של בועות שאפשר לעקוב אחריהם אחורנית עד לנקודות ספציפיות בכוס: נקודות אלו הן מיקרו-סדקים המשמשים אתרי נוקלאציה. כאשר מוזגים משקה מוגז לכוס, נוצר קצף רב מכיוון שכל הסדקים המיקרוסקופיים פועלים כבתי ייצור סדרתיים של בועות: בכל פעם שמשתחררת בועה, האתר שיצר אותה מתפנה ליצירת בועה נוספת וכך שוב ושוב עד שנגמר ה-CO2 או שמושג שיווי משקל דינאמי חדש. כדי להימנע מהקצף, ידוע לבארמנים שצריך להרטיב קודם את החלק הפנימי של הכוס, אבל למה? מולקולות המים ‘סותמות’ זמנית את הפגמים המקרוסקופיים שבזכוכית ובכך מורידות באופן ניכר את הסיכוי להיווצרותן של בועות. ההבדל מרשים – כמעט שלא נוצר קצף.
‘מנטוס בקולה’ הוא אחד הניסויים שהפך לאייקון תרבותי בזכות מאות סרטונים שהועלו ליוטיוב על ידי כל בן 11 עם מצלמת וידאו. בתחילה לא היה ברור לי מדוע מזנק גייזר אדיר מפיית הבקבוק – זה נראה כמעט לא טבעי. האם יש במנטוס חומר מסתורי שגורם לגזים להשתחרר בעוצמה? מסתבר שלא. למרות שסוכריית המנטוס נראית ומרגישה חלקה, למעשה, מהבחינה מקרוסקופית היא מחוספסת ביותר. כאשר היא צוללת לתוך המשקה, הנקבוביות הרבות שעליה מהוות אתרי נוקליאציה עבור ה-CO2 המומס בקולה ובבת אחת נוצרות אין-ספור בועות המשתחררות בעוצמה סילונית וגורפות עימן גם חלק מהנוזל. ההסבר המלא מורכב יותר (ויש גם בויקיפדיה), אבל זה הרעיון הבסיסי. צוות התוכנית המרתקת Time Warp, המתמחה בצילום מהיר (הרבה פריימים בשנייה) בדק את הנושא:
כראייה לכך שאין במנטוס משהו מיוחד, מתקבל אפקט דומה גם אם נפזר על המשקה המוגז שלנו חול, סוכר או מלח כפי שניתן לראות כאן.
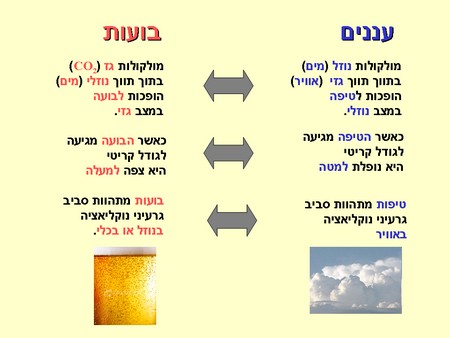
הספר Clouds in a Glass of beer מתאר ניסויים פשוטים שממחישים עקרונות פיזיקאליים של תופעות מזג אוויר. בפרק הראשון מסביר המחבר מדוע במובנים רבים, עננים הם תמונת הראי של בועות במשקה מוגז. עננים נוצרים כאשר הלחות היחסית גבוהה מספיק על מנת שמולקולות מים במצב גזי (אדים) יתעבו לטיפות קטנות. על מנת לזרז את הגשם, מפזרים באוויר (או למעשה, ‘זורעים‘) חלקיקים זעירים שיהוו גרעיני נוקליאציה עבור הטיפות, וזאת בהקבלה לפיזור מלח בבירה שמזרז הווצרות של בועות. אפשר, כמובן, להוסיף עוד פרטים להקבלה המהופכת:
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
לפני שניפרד מהבירה בואו נבחן עוד תופעה מעניינת. כאשר פותחים את הפקק, מופיעה עננה קטנטנה בראש הבקבוק. מהי עננה זו וכיצד היא נוצרה? ראשית, נזכיר עקרון תרמודינאמי ידוע: שינוי מהיר בלחץ גזי גורר עמו שינוי בטמפרטורה. למשל, כאשר גז נדחס במהירות הטמפרטורה שלו עולה (משאבת אופניים מתחממת בזמן הניפוח) וכאשר גז מתרחב במהירות הטמפרטורה שלו יורדת (מיכל גז דחוס מתקרר לאחר כמה לחיצות). אגב, את העקרון הזה אנו פוגשים בכל פעם שאנו משתמשים במזגן או במקרר המבוססים על מחזורים של דחיסה והגדלת נפח של גז. לאור זאת, ניתן להבין מדוע ירידת הלחץ בפיית הבקבוק מורידה שם את הטמפרטורה. תאמינו או לא, אבל מדובר בירידה דראסטית לסביבות מינוס שלושים מעלות צלזיוס, שגורמת לאדי המים שנמצאים שם להתעבות מידית לטיפות מים זעירות, כלומר, להפוך לענן (או ערפל). אילו היו באזור הפייה גרעיני נוקליאציה, כמו חלקיקי אבק זעירים, אותה התעבות היתה מתקבלת גם בטמפרטורות רגילות, כפי שמוכיח ניסוי פשוט זה שתוכלו לעשות בבית, אם בינתיים הבירה לא עלתה לכם לראש.

8 תגובות
היי, כאן אורן פרבר (הכותב)
הבלוג החדש שלי נמצא פה: orenmada.net/blog
עם המון תכנים חדשים…
אני מבקש שאף אחד לא יעשה שום ניסויים בבירה של אבא.
אבא צריך אותה בשביל קצת שקט נפשי.
אהוד,
למה לא לנסות זאת בבית?
אלא אם התכוונת שילדים לא צריכים לשתות בירה — עם זה אני מסכים לחלוטין. הן יכולים, אבל, לבצע ניסויים בבירה של אבא!
סטודנט
לטעמי רק מהצפייה בסרט הוידאו יש כאן יותר מאשר שטח פנים גדול ליצירת בועות שיש
למנטוס. נראה לי מסקלת הזמנים הקצרה כי יש כאן תופעה המגבירה את עצמה.
אנסה להסביר. המנטוס מהווה מרכז נוקליאציה אבל לא די בכך שאילו כך היו
פני הדברים סקלת הזמן האופיינית הייתה הזמן שלוקח לגז במקרה זה C02
לזרום אל המנטוס אני מניח כי הוא היה עושה זאת בדיפוזיה וסקלת הזמן הייתה
איטית יחסית.
לדעתי המנטוס מהווה מרכז נוקליאציה וסוחף אליו גז. זרימת הגז אל המנטוס מגבירה
את יצירת הבועות ואילו הבועות מגבירות את הזרימה של הגז אל המנטוס. יש כאן תופעה
המגבירה את עצמה. בועות יוצרות זרימה למנטוס וזרימה למנטוס יוצרת עוד בועות.
במצב כזה אני מצפה כי יהיה סף מסויים לתופעה, או גודל אופייני למנטוס המסוגל לייצר זרימה כזו.
מה יקרה אם נזרוק חצי מנטוס או רבע? האם הזרימה תקטן פי 2 או פי 4 איני סבור כך
שכן מדובר בגידול אקספונניצלי.
ילדים אל תנסו זאת בבית!
אהוד, הנושא מן הסתם יותר מורכב מההסבר הפשטני בכתבה. כדי להבין תופעה כזאת באופן מדויק צריך לעשות טיפול תרמודינמי סטטיסטי מלא עם שילוב של כימיה של השטח.
באופן כללי, שטח הפנים של המנטוס גדול יחסית (הוא מחוספס ולא חלק, לכן יש הרבה שקעים ובקעים במשטח, דבר שמגדיל הרבה את שטח הפנים), ויש שם פי מספר גדול מאוד של אתרי נוקלאציה מאשר בכוס. לכן בהכנסת המנטוס אתה מוציא את המערכת מש”מ וקצב ההתגרענות עולה מהר מאוד, ומקבלים את ה”בום”.
נניח תאורטית שהיה בכוס כמות אינסופית של CO2 מומס, לאחר זמן מסוים ההתגרענות סביב אותה סוכרית מנטוס הייתה מגיעה לש”מ והקצב של היווצרות הקצף היה מגיע למקסימום. אם בשלב הזה היית מכניס עוד סוכריה היית מכפיל את מספר אתרי ההתגרענות ו”כמות” הקצף הייתה עולה פי 2 (בהנחה שהיווצרות הקצף לינארית למספר אתרי ההתגרענות). זה כמובן תיאור מאוד כללי ולא מדויק, אבל זה הרעיון.
עושה רושם שהתופעה הרבה יותר מורכבת ממה שתואר בכתבה.
שאלות שעולות הן:
מה קובע את סקלת הזמן האופיינית? בכוס בירה היווצרות
הבועות היא איטית במקרה של המנטוס עושה רושם כי קצב ההתרחשות
היא אקספוננצילית מהירה יותר. מה גורם להתנהגות השונה?
האם במנטוס יש מספר אקספונניצילי של מרכזי נוקליאציה או שמדובר
בתופעה המגבירה את עצמה?
בגלל זה אני אוהב מדע
כמה פעמים הסתכלתם על הבועות הנוצרות בכוס סירה או סודה ושאלתם את עצכמם כיצד הם נוצרות?
לא הייתי מתנגד ללמוד שיעור פיזיקה וכימיה על כוס בירה.