מתברר שהשִליה, החלק הכי פחות נחקר מכל חלקי גוף האדם, טומנת בחוּבה הפתעות רבות
מאת אדריאן ארְלֶבּייקר, סוזן ג' פישר, הכתבה מתפרסמת באישור סיינטיפיק אמריקן ישראל ורשת אורט ישראל 26.10.2017
- היריון מוצלח תלוי בהתפתחות ובתפקוד תקינים של השליה, איבר לא רגיל שגם מפריד וגם מקשר בין האם ההרה לעוּברה.
- מחקרים חדשים מציעים הסבר לשאלות מדוע מערכת החיסון של האם אינה דוחה את היילוד כפי שהיא דוחה רקמות זרות, ואיך תאים של האם עוזרים בפועל ביצירת השליה ובהסתננות שלה לרחם.
- הבנה טובה יותר של תפקוד לקוי של ממשק האם־עובר יכולה להסביר סיבוכים מסוכנים של ההיריון, כמו לידה מוקדמת, פיגור גדילה תוך־רחמי ורעלת היריון.
- חוקרים מנסים להבין גם כיצד כמה נגיפים, כמו זיקה, מסוגלים לפרוץ את השליה ואילו נגיפים אחרים אינם יכולים לעשות זאת.
במשך עשרות שנים סברו מומחי בריאות הציבור שנגיף זיקה גורם באנשים רק מחלה מתונה באופן יחסי. אבל כשהמחלה התפרצה בברזיל ב-2015, התברר למרבה הזוועה שהנגיף יכול לעבור מנשים הרות לעוברים שלהן ולגרום לתוצאות איומות. הנגיף הורג מקצת מן העוברים ופוגע קשות במוחם של אחרים, בין השאר ראשים קטנים מן הרגיל (תופעה הנקראת מיקרוצֶפליה). הדרך שבה מגיע הנגיף לעובר היא בגדר תעלומה, משום שכדי לעשות זאת עליו לעבור את השליה, איבר דמוי לביבה המחבר את התינוק המתפתח לאם ומצליח לחסום מעבר מאם לעובר של נגיפים קרובים לזיקה שמקורם ביתושים, כמו נגיפי דנגי וקדחת צהובה.
בשנים האחרונות, הפנתה חידה זו ואחרות את תשומת לב החוקרים לכיוון השליה שהיא האיבר הראשון והגדול ביותר המתפתח לאחר ההתעברות. השליה היא תוצר של העובר ולא של האם, ובין שאר הדברים היא מספקת לעובר חומרי מזון וחמצן ונפטרת מחומרי הפסולת. ואולם, על אף תפקידה הגורלי בהיריון, אין ספק שהיא האיבר הכי פחות מובן בגוף.
היעדר החסינות של השליה לנגיף זיקה אינה החידה היחידה. חוקרים תהו רבות מדוע מערכת החיסון של האם אינה מתייחסת לשליה ולעובר כאל חומרים זרים מבחינה גנטית ולפיכך כמטרה להתקפה. למעשה, לא זו בלבד שמערכת החיסון של האם בולמת את עצמה, אלא שלאמיתו של דבר היא אף עוזרת בהתפתחות השליה ובתפקודה.
מחקרים שנערכו במעבדות שלנו ובאחרות החלו להניב תובנות מרתקות לשאלות אלו. באמצעות הממצאים האלה אנחנו מבינים יותר ויותר שסיבוכים מסוימים בהיריון, שנחשבו בעבר כבעיה הנובעת אך רק מגוף האם, נגרמים למעשה מפגמים בשליה או בקשר שלה עם הרחם. יותר מכך, שינויים זעירים בשליה עשויים להשפיע על בריאותו של האדם מאוחר יותר בחייו.
התפתחות מהירה
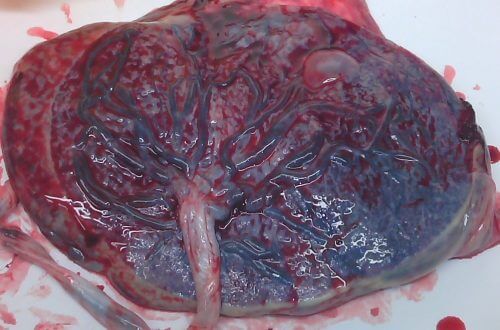
אף שיש שפע של תעלומות הקשורות לשליה, בכל זאת אנו מבינים היטב שני היבטים שלה: מבנה האיבר והשלבים הבסיסיים בהתפתחותו. בזמן הלידה, משקלה של השליה, הנראית כנתח בשר, הוא כחצי קילוגרם ויש לה שני צדדים מובחנים: החלק המחובר לדופן הרחם של האם לפני הלידה נראה כמו ספוג טבול בדם, ואילו החלק הפונה אל התינוק מכיל מערך של כלי דם המתנקזים לחבל הטבור [ראו תמונה].
השליה מתפתחת במהירות משום שעליה למלא את תפקידיהם של איברים מתפתחים אחרים עד שיגיעו למלוא תפקודם. כמו הכבד, היא מעבדת את חומרי המזון; כמו הריאות, היא מחליפה חמצן ופחמן דו־חמצני וכמו הכליות, היא מפרישה חומרי פסולת. פחות משבוע אחרי שהזרע מפרה את הביצית עולים תאים מתמחים, המכונים טְרוֹפוֹבְּלַסטים, על פני השטח של העובר. תפקידם של התאים האלה (שגם מייצרים הורמונים המודיעים לגוף האם על נוכחות העובר) הוא להתחפר בדופן הרחם. שם, הם מתרבים במהירות ויוצרים בליטות המסתעפות לתוך הרחם. שכבה אחת מורכבת מתאים הקרויים: ציטוטרופובלסטים ושכבה נוספת של תאים מאוחים (סינציטיוטרופובלסטים) יוצרת את השכבה החיצונית של השליה. בסופו של דבר, השליה מקבלת צורה של דיסקה המחוברת לדופן הרחם באמצעות מבנים מסועפים.
במהלך השבועות השני והשלישי שלאחר ההפריה, מתחילים סעיפים אלה להתמלא בתאים תומכים ובכלי דם. בערך בזמן שהאישה יודעת שהיא הרה, מתייצבת צורתם הבוגרת של המבנים האלה המכונים סיסֵי שליה.
במרוץ של השליה נגד הזמן כדי להגיע לתפקוד מלא מוקדם ככל האפשר בהיריון, היכולת שלה להטות את זרימת הדם מן האם אליה עצמה עומדת בראש סדר העדיפויות. המסע היוצא מן הכלל שעושים הציטוטרופובלסטים הוא המאפשר את הישג הזה. ראשית, התאים האלה קושרים את עצמם לפני השטח של דופן הרחם, אז הם נודדים עמוק יותר פנימה. לפני כעשרים שנה גילתה אחת מאתנו (פישר) שהציטוטרופובלסטים משנים את צורתם במשך התהליך הזה ומחקים את התאים שבדרך כלל מרפדים את כלי הדם. חיקוי זה מאפשר לציטוטרופובלסטים לפרוץ לעורקי האם הגדושים בחמצן [ראו איור מרכזי]. ברגע שהם בפנים, הם מטפסים על כל אחת מן השכבות המרפדות את כלי הדם ומחליפים אותן.
בזכות התחבולה הזאת של התאים, עורקי האם המצויים ברחם מתרחבים ומאבדים את אופיים הרגיל שאם לא כן תוגבל כמות הדם שהם יכולים להזרים. לקראת סוף השליש הראשון של ההיריון נפתחים העורקים אל תוך המרווחים שבין סיסי השליה ומעבירים כמויות גדולות של דם מן האם, המכיל חומרי מזון וחמצן הדרושים לגידול הצאצא. הציטוטרופובלסטים פולשים גם לוורידי הרחם וכך מאפשרים לדם לזרום מן ההשליה בחזרה אל גוף האם ולהרחיק פחמן דו־חמצני וחומרי פסולת אחרים מן העובר. כך נסגר המעגל.
דם מן העורקים של האם שוטף את שטח הפנים של השליה במרחק שאינו עולה על כמה שכבות תאים מכלי הדם של העובר. קרבה זו ממקסמת את החלפת חומרי המזון, הגזים ותוצרי הפסולת. חוקרים קבעו בשנים האחרונות שהשליה משחררת כמויות גדולות של דנ"א של העובר לתוך דם האם, מה שמאפשר לערוך בדיקות גנטיות טרום־לידתיות בדגימות דם של האם. הבדיקות האלה מחליפות במהירות את הבדיקות בשיטות הישנות שחייבו הליכים חודרניים יותר כמו לקיחת דגימות מסיסי השליה או ממי השפיר.
השפעות סביבתיות
הגֶנים של העובר מנתבים את רוב שלבי ההתפתחות של השליה, אבל גם לסביבה הקרובה האופפת את האיבר תפקיד חיוני בהתפתחותו. בעשרים השנים האחרונות החלו חוקרים לגלות עד כמה היריון מוצלח תלוי בהחלפה תקינה של תאים ברקמת הרחם של האם בענפים הפולשים של השליה. האזורים שבהם השליה והרחם נפגשים, הקרויים ממשק אם־עובר, מכילים סוגים שונים של תאים ממערכת החיסון הקרויים לויקוציטים הנודדים לאתר מדם האם. הטרופובלסטים של העובר מקיימים דו־שיח מתמשך עם הלויקוציטים האלה ועם תאים אחרים ברחם כדי לוודא שהשליה תפעל כראוי.
התנהגותם של תאי החיסון של האם מפתיעה. השליה, שמחצית מן הגנים שלה מקורם באב היא מטבע ברייתה זרה לאם. זרות זו מעלה את השאלה: כיצד מצליחה השליה להתחמק מדחייה בידי תהליכים חיסוניים שבמקרים אחרים היו מזהים פולשים כמוה והורסים אותו, כמו שקורה בהשתלת איברים שגרתית? חוקרים יודעים כיום ששינויים במערכת החיסון של האם עוזרים לה "לנהוג בסובלנות" כלפי השליה. גם תהליכים מקומיים המתרחשים ברחם משתתפים בזה. לדוגמה, מחקר שנערך בעכברים ופורסם ב-2012 בידי אחד מאיתנו (ארלבייקר) הראה שלויקוציטים, הגורמים בדרך כלל לדחיית איבר מושתל, אינם מסוגלים להצטבר על דופן הרחם קרוב לשליה הפולשת.
ואולם, גוף האם אינו מסתפק בסובלנות כלפי השליה, הוא גם מעודד באופן פעיל את גידול רקמות העובר הפולשות. החל משנות ה-80, לדוגמה, גילו חוקרים סוג של לויקוציטים הקרויים תאי הרג טבעיים (NK) המצויים בשפע בממשק אם־עובר בצד של הרחם. ככלל, תאים מתמחים אלה הורגים גידולים ותאים שנדבקו בנגיפים. אבל בשנות ה-90 חשפו חוקרים בראשות ב' אן קרוי, החוקרת כיום באוניברסיטת קווינס באונטריו, תגלית הנוגדת את השכל הישר: תאי NK יכולים לתמוך בהתפתחות השליה, ובייחוד בהסבה של עורקי הרחם בידי ציטוטרופובלסטים. נראה שתאי NK ברחם מייצרים חומרים המעודדים את הרס תאי האם המקוריים המרפדים את העורקים ובכך מסייעים להשתלטות של תאי השליה על כלי דם אלה.
בעיות בממשק
בהתחשב בקצב הרצחני שבו מתפתחת השליה ובסוגי התאים הרבים המרכיבים אותה ואת דופן הרחם, אין זה מפתיע ששגיאות עלולות לקרות במהלך יצירת הממשק אם־עובר. שגיאות כאלה עלולות לגרום להופעה של מגוון רחב שלסיבוכים בהיריון ובלידה, בין השאר, לידה מוקדמת (לפני השבוע ה-37 של ההיריון), פיגור גדילה תוך־רחמי (העובר קטן מן המצופה) ורעלת היריון (אצל האם מתפתחים פתאום לחץ דם גבוה ונזק בכלי הדם).
מחקרים שנעשו לאחרונה על השליה עוזרים להבהיר את מקורם של כמה מן הסיבוכים האלה. רעלת היריון נחשבה פעם ל"רעלת" ממש, משום שרופאים סברו שמקורה ברעלנים שהשליה משחררת לדם האם. אף שהמנגנון המדויק שגורם לתופעה, הפוגעת ב-8% מן ההיריונות הראשונים, עדיין אינו ידוע, חוקרים מצאו שהוא קשור לפגמים מבניים מובחנים בממשק אם־עובר. מומחים סבורים כיום שהמצב נובע מפלישה לקויה של ציטוטרופובלסטים לעורקים ברחם במחצית הראשונה של ההיריון. כתוצאה מכך, זרימה לקויה של דם מגבילה את צמיחת העובר. בסופו של דבר, בשל ההתפתחות הבלתי תקינה של השליה היא אכן משחררת חומרים רעילים לאם, בייחוד למחזור הדם, אבל לא נראה שהרעלנים האלה הם שורש הבעיה כפי שחשבו קודם. ייתכן שהם תוצאה נלווית של המחלה. ללא טיפול, רעלת היריון עלולה לגרום לנזק רציני, אפילו קטלני, לאם ולתינוק.
הסיבה לכשל של השליה ברעלת היריון עדיין מעורפלת. התפקוד הלקוי יכול לנבוע מן הציטוטרופובלסטים או מתאים שונים של האם או משילוב של השניים. ייתכן שליכולתם של תאי ההרג הטבעיים להבחין ברקמה זרה יש תרומה כלשהי. מחקר שהובילה אשלי מופט, מומחית לאימונולוגיה של הרבייה באוניברסיטת קיימברידג', מציע שאם השליה והאם קרובות מדי זו לזו מבחינה אימונולוגית, תאי ההרג הטבעיים אינם מצליחים לתמוך כראוי בהחלפת התאים מן השכבה הפנימית המרפדת את עורקי הרחם של האם בתאים מן השליה.
סיבוך חמור אחר, לידה מוקדמת, משך לאחרונה תשומת לב משום ששכיחותו הולכת וגוברת ברחבי העולם. על פי המרכזים לבקרת מחלות ומניעתן (CDCs), התופעה פוגעת עכשיו באחד מתוך כל עשרה הריונות בארה"ב. אף שדלקת תוך־רחמית עלולה לגרום ללידה מוקדמת, אין סיבה ברורה לרבות מן הלידות המוקדמות. למעשה מדענים עדיין אינם מבינים מה מעורר לידה נורמלית בסוף ההיריון. זאת אחת השאלות הפתוחות החשובות בביולוגיה של האדם. כפי הנראה יש "שעון" כלשהו המונה לאחור את 280 ימי ההיריון האנושי. אנו יודעים שכשהשעון מצלצל מתחיל רצף של תגובות דלקתיות ברחם שהם כנראה הסיבה המידית להתכווצויות הרחם וללידה. אבל היכן מתקתק השעון? האם בעובר, בשליה או ברחם? קל לדמיין שהתפתחות פגומה של השליה בתחילת ההיריון עלולה לקלקל את המנגנון הפנימי של שעון הלידה, אך רעיון זה נשאר בגדר השערה.
סיבוכי הלידה העיקריים חופפים בסימניהם ובמנגנונים הבסיסיים שלהם. פלישה שטחית מדי של ציטוטרופובלסטים, הקשורה בעקביות עם רעלת היריון, לדוגמה, היא גם סממן של פיגור גדילה תוך־רחמי וכמה מקרים של לידה מוקדמת. הבנה טובה יותר של הדרך שבה בעיות בממשק אם־עובר מסתעפות לסיבוכים שונים מאוד תציע דרכי טיפול יעילות יותר.
חותָם מתמשך
לסיבוכים החמורים האלה בהיריון יש בוודאי השפעות מזיקות על היילודים. החל בפגיעות ניתנות לטיפול, הדורשות אשפוז ביחידות טיפול נמרץ ליילודים ועד ליקויים קבועים במערכת העצבים. אבל ההשפעות המזיקות של סביבה תוך־רחמית שאינה מתאימה לגידול העובר אינן מסתיימות בינקות, הן עלולות להופיע עשרות שנים לאחר הלידה כמחלות במבוגרים ויש סיבה לשער שפגמים בתפקוד השליה ממלאים תפקיד גם בהן.
לרעיון שהתנאים ברחם יכולים להשפיע על הבריאות מאוחר יותר בחיים הוענק הכינוי: השערת המקורות העובריים. האפידמיולוג הבריטי המנוח דייוויד ברקר העלה אותה לראשונה בשנות ה-80 כדי לנסות להסביר את השכיחות הגבוהה של סוכרת ומחלות לב וכלי דם באזורים העניים של בריטניה. ברקר שם לב להתאמה בין שיעור המבוגרים במצבים הכרוניים האלה ובין משקל נמוך בלידתם ששיקף כנראה מצב תזונתי ירוד. כמה חוקרים סבורים שתזונה לקויה ותפקוד פגום של השליה יכולים לשנות את האופן שבו הגנים של התינוק מווסתים את התפתחותו במהלך ההיריון, אך המנגנונים שבבסיס התהליך הזה אינם ידועים. הוכחות אפידמיולוגיות גם מעידות בבירור שילדים שנולדו לאימהות שחלו בזמן ההיריון במחלות זיהומיות מסוימות, כמו שפעת, מצויים בסיכון גבוה יותר ללקות בהפרעות פסיכיאטריות והפרעות בהתפתחות העצבית, ובכללן אוטיזם, הפרעה דו־קוטבית וסכיזופרניה.
היריון מוצלח תלוי בהחלפת תאים ברקמת הרחם של האם בענפים הפולשים של השליה.
מחקר בעכברים שפרסמו ב-2016 האימונולוגים דן ר' ליטמן מאוניברסיטת ניו יורק וז'וּן ר' הוּ מבית הספר לרפואה של אוניברסיטת מסצ'וסטס מראה כיצד זיהום בשפעת עלול לשנות קלות את מהלך התפתחות המוח בדרך שתבוא לידי ביטוי רק כמה שנים או כמה עשרות שנים מאוחר יותר. קודם לכן, מדענים ידעו שחומרים הפועלים בדומה לנגיפים וגורמים זיהומים מערכתיים בעכברות הרות גורמים גם להתנהגות דמוית אוטיזם בצאצאיהן. ליטמן, הו ועמיתיהם הראו שהחומר שמשרה את הדלקת הוא החלבון אינטרלוקין-17 (IL-17) והוא נוצר בתאי מערכת החיסון של האם. שיטות דימות מתוחכמות אפשרו לצוות להוכיח שהחלבון הזה היה האחראי הישיר לשינויים מבניים עדינים במוחם של עכברים נגועים.
ואולם, כיצד עובר IL-17 שמקורו באֵם את השליה ומגיע למוחותיהם של העוברים בשעה שמולקולות אחרות בגודל דומה אינן יכולות לעבור? אפשרות אחת היא שמסיבה כלשהי השליה מעבירה באופן פעיל IL-17 מדם האם למחזור הדם של העובר ומאפשרת לחלבון להגיע למוח. אפשרות מעניינת אחרת היא שכמה מן התאים של האם המייצרים IL-17 חוצים את השליה ומגיעים לעובר.
חֲצָיָה
מגפת הזיקה הדגימה באופן מוחשי ונראה לעין את הנזק שעלול להיגרם כשנגיף המדביק את האם לומד לחצות את השליה. ואף על פי כן, כרגע לחוקרים יש יותר שאלות מתשובות לדרך שבה נגיף זיקה גורם לבעיות הרפואיות שהתעוררו בתינוקות שנדבקים.
בהתחשב בעובדה שרק לאחרונה הבינו החוקרים את הקשר שבין הידבקות בנגיף זיקה במהלך ההיריון לתוצאות המזיקות, אין זה מפתיע שכה מעט ידוע על הדרך שבה מגיע הנגיף לעובר. אפילו שיעור המומים המולדים אינו ידוע, ונראה שהוא תלוי במיקום. במחקר שנערך בארה"ב, וראה אור בינואר 2017 בכתב העת של האגודה הרפואית האמריקנית (JAMA), חוקרים במחלקות לבריאות ציבורית ובמרכזים לבקרת מחלות ולמניעתן מצאו מומים מולדים רק ב-6% מן העוברים או היילודים של אימהות שכנראה נדבקו בזיקה. ואילו מחקר שנערך בברזיל ופורסם חודש קודם לכן בכתב העת לרפואה של ניו אינגלד מדווח שכמעט במחצית העוברים הנגועים יש נזק כלשהו. בנוסף, כמה תינוקות ברזילאים פיתחו בעיות עצביות לאחר שבלידתם אובחנו כבריאים. מאחר שנראה שרוב ההשפעות המזיקות של זיקה, בעיקר ראש קטן, שכיחות יותר בברזיל בהשוואה למקומות אחרים, כמה חוקרים שיערו שייתכן שכימיקל כלשהו המצוי בסביבה בברזיל מחליש את השליה ועושה אותה פגיעה יותר לזיקה. או לחלופין, ייתכן שדבר נובע מהדבקה בו־זמנית בזיקה ובחיידק או נגיף אחר הנפוץ בברזיל.
שאלה פתוחה אחרת היא כיצד מגיע זיקה לעובר. האם הוא עובר דרך השליה מצדה של האֵם ומדביק כל סוג של תאים הנקרה בדרכו או שהוא "תופס טרמפ" על תאים מסוימים, כמו תאים ממערכת החיסון של האם? לחלופין אנו יודעים שמחוללי מחלה מסוימים יכולים לעלות מן הנרתיק לרחם וכך לזכות בגישה לרקמות העובר. בכל מקרה, כשנגיף זיקה מגיע לרקמות העובר, הוא מבסס בהן אחיזה עזה. פתולוגים מולקולריים ב-CDC דווחו שנגיף זיקה יכול להישאר בשליה במשך חודשים, ולהמשיך להתרבות במוח היילוד גם לאחר הלידה.
זיקה כמובן אינו מחולל המחלה היחיד שיכול לחצות את השליה ולהזיק לעובר. כ-100,000 תינוקות ברחבי העולם נולדים עם תסמונת רובלה מולדת (כתוצאה מהידבקות האם באדמת) שעלולה לכלול חֵרשות, מומים בעיניים, מחלות לב ועוד בעיות קשות. גם מלריה, הרפס ואבולה עלולים לגרום נזק קטלני במהלך ההיריון, ועדיין לא ידוע כיצד הם פולשים לעובר. אך נראה שכמה מחוללי מחלה יכולים יעילים יותר מאחרים בהדבקת הטרופובלסטים בשליה, בייחוד בתחילת ההיריון. מנגנוני ההגנה של מערכת החיסון בממשק אם־עובר, גם הם כושלים לעיתים בתפקיד שומרי הסף בהתחשב בעובדה שעל הרקמה המרפדת את הרחם מטבע ברייתה למלא שני תפקידים סותרים. מצד אחד, היא חייבת להגן על העובר ועל השלייה מזיהומים, אבל מן הצד האחר, כאמור, היא חייבת למנוע ממערכת החיסון של האם להגיב בתוקפנות יתר כדי שלא להזיק לשליה.
מאחר שיש ללמוד על השליה וההיריון הרבה כל כך, החל לפני שלוש שנים המכון הלאומי האמריקני לבריאות הילד ולהתפתחות האדם על שם יוניס קנדי שרייבר את מיזם השליה האנושית שמטרתו להבין את האיבר המסתורי הזה ש"משפיע לא רק על בריאות האישה והעובר שלה במהלך ההיריון אלא גם על בריאות שניהם במהלך חייהם." יחד עם המאמצים לרפא HIV, סרטן ומחלות לב וכלי דם, להבנת השליה תינתן עדיפות גבוהה בסדר היום של מחקר הבריאות בארה"ב.
