מחקרים חדשים שמראים שמחסום הדם-מוח הוא מערכת דינמית ופעילה יכולים להביא למהפכה בטיפול במחלות כמו סרטן ואלצהיימר
במהלך אחד מניסויי צביעת הרקמות המפורסמים שערך פאול ארליך בסוף המאה ה-19, אחד הניסויים שבסופו של דבר הביאו לריפויה של מחלת הזיבה ולפרס נובל, הוא נתקל בתופעה שמוסיפה להעסיק מדענים עד היום. חומר צבע שהוזרק למערכת הדם של עכברים חדר לכל הרקמות חוץ מאשר למוח. תאי הכליות, הכבד והלב של העכברים, שנצפו מתחת למיקרוסקופ, נצבעו בצבע סגול-כחול חזק וברור, אבל צבעם של תאי המוח נשאר לבנבן-צהבהב. כשהזריק אחד הסטודנטים שלו את חומר הצבע היישר למוחם של העכברים התקבלה תוצאה הפוכה: רקמת המוח נצבעה בצבע כחול, אך שאר האיברים לא נצבעו. ברור, חשב לעצמו הסטודנט, חייב להיות מחסום כלשהו (המכונה בגרמנית Blut-Hirn-Schranke) בין המוח לבין מערכת הדם.
רק כעבור חצי מאה ובעזרת מיקרוסקופ חזק פי כ-5,000 מזה שהשתמש בו ארליך, הצליחו מדענים לאתר את המחסום החבוי בתוך מערך כלי הדם של המוח. המוח האנושי הממוצע מכיל כלי דם שאורכם כ-640 קילומטרים. הם מתפתלים ומתעקלים במערך אין-סופי של לולאות סבוכות, המקיפות, בסופו של דבר, כל אחד מכ-100 מיליון תאי העצב שבמוח. דפנותיהם של כלי דם אלה מצופים בשכבה של תאי אנדותל, כפי שמצופים דפנותיהם של כל כלי הדם בגוף. אבל תאי האנדותל המצויים על פני כלי הדם המזינים את המוח מאורגנים בשכבה הדוקה הרבה יותר, ארגון המסביר מדוע חומרי הצבע שהזריק ארליך, כמו גם רוב התרופות המצויות היום בשימוש, אינם מסוגלים לחדור ממחזור הדם אל המוח.
ואולם, הרבה לפני שהצליחו החוקרים לצפות במחסום הזה באופן ישיר, למדו הרופאים להוקיר אותו ולהימנע מלפגוע בו. "במשך עשרות שנים ראינו במחסום הדם-מוח סוג של קיר לבנים בלתי חדיר," אומר לסטר דְרֶוֶוס, ביולוג של כלי דם ומומחה למחסום הדם-מוח מאוניברסיטת מינסוטה. "ההסכמה הכללית הייתה שהוא מצוי שם מסיבה מסוימת ושאל לנו להתעסק אתו.”
כיום השתנתה הגישה הזאת. מדענים שונים גילו כי קיר הלבנים הקשיח הומה למעשה מפעילות. תאים משני צדיו של המחסום, במוח ובדם, מתקשרים ומשפיעים זה על זה. ויותר מזה, מגוון רחב של מעברים ייעודיים למולקולות מסוימות, המצויים בקרומי התא של תאי האנדותל, מווסתים כניסה של חומרים אל המוח, חוסמים חומרים מסוימים ומעבירים אחרים. אפילו תאי דם לבנים שבעבר נחשבו כגדולים מכדי לחדור דרך המחסום, עוברים דרכו באופן שגרתי כדי לתור אחר פולשים חיצוניים.
כדי להיטיב ולתאר את הממצאים, החלו מדענים לכנות את המחסום בשם "יחידה נוירו-וסקולרית" (של עצבים וכלי דם): כלומר, הם הפסיקו לראות בו מחסום קשיח העשוי מתאי אנדותל כי אם כעין איבר חיוני המורכב מסוגי תאים שונים הכוללים גם את התאים שמקיפים את תאי הדם, והממלא תפקיד מכריע בהתפתחות הגוף, בהזדקנות ובעת מחלה. בזכות מהפכה נוספת בתחום המיקרוסקופיה, יכולים כיום מדענים לצפות באופן ישיר בפעילותו של איבר זה.
מחסומים מנותצים
מחסום הדם-מוח, כפי שהוא נראה דרך מיקרוסקופ "שני פוטונים" של המדענית מַייקֶן נֶדֶרגַארד מאוניברסיטת רוצ'סטר, הרבה יותר מרתק ממה שארליך היה יכול לדמיין. נדרגארד, שלא כמו ארליך, צופָה במוחם של בעלי החיים (עכברים לשם הדיוק) בעודם חיים ונושמים. היא מסירה חלק מן הגולגולת של העכבר, מזריקה חומר צבע למחזור הדם שלו ואז צופה במחסום הדם-מוח בזמן אמת. תאים עוברים את המחסום ממחזור הדם אל המוח דרך דפנותיהם של נימים דקים המורכבים משכבה יחידה של תאי אנדותל. המראה מעורר השראה, בייחוד משום שהמחסום היה כה בלתי נגיש כשהחלה נדרגארד את הקריירה המדעית שלה לפני כ-20 שנה.
שיטת המיקרוסקופיה של שני פוטונים, היא טכנולוגיית הדמיה מתקדמת המאפשרת לחדור את 300 המיקרונים העליונים של קליפת המוח. לפני פיתוחה לא היה באפשרותם של החוקרים לאסוף נתונים טובים הרבה יותר מנתוניו של ארליך, כלומר, צפייה ברקמות מתות שקובעו על גבי זכוכיות נושאות של מיקרוסקופים. הניסויים האלה, אומרת נדרגארד, לימדו את הביולוגים מעט מאוד על פעילותו האמיתית של מחסום הדם-מוח. הסיבה לכך היא שזרימת הדם הכרחית לפעולתם התקינה של המוח ושל המחסום. ההבנה עד כמה בעצם חיונית זרימת הדם לפעילותו של המחסום הפתיעה ואתגרה את מחשבתם של החוקרים העוסקים בתחום.
למשל, בסדרת ניסויים שערכו לאחרונה נדרגארד ועמיתיה הם מצאו שכשמגרים קבוצה מסוימת של תאי עצב, גדל קוטרם של כלי הדם בסביבה כדי שיהיו מסוגלים להוביל דם וחומרי מזון רבים יותר בדיוק ברגע שבו תאי העצב מתחילים לירות. אם מחלישים את עוצמת הגירוי, כלי הדם מתכווצים וכמות חומרי המזון המופנים לאזור זה קטנה. "זה תהליך דינמי מאוד," אומר דְרֶוֶוס.
זה גם תהליך מורכב באופן שקשה לתאר. סביב הנימים ממוקמים תאים המכונים אַסְטְרוֹציטים ופֶּריציטים שמקיפים את כל כלי הדם במוח ומסייעים בתקשורת בין תאי העצב, מחזור הדם ותאי האנדותל. בתורם, התאים האלה מוקפים בתאים מסוגים אחרים.
מבין כל סוגי התאים, נדרגארד מוצאת עניין מיוחד בתאי מיקרוגְלִייה, תאים במערכת העצבים המרכזית המקבילים למאקרופאגים, כלומר תאים בולעניים העוסקים בהגנה על הגוף. תאי המיקרוגְלִייה מפטרלים באופן קבוע במוח ובחוט השדרה ומחפשים תאים פגועים וגורמי מחלה אחרים כדי להשמיד אותם. קיומם של תאי מיקרוגְלִייה פגועים נקשר זה זמן רב למחלות עצבים ניווניות כמו אלצהיימר ופרקינסון. נדרגארד חושדת שהקשר הזה נובע מאי יכולתם של תאי המיקרוגְלִייה הפגועים להגן על מחסום הדם-מוח.
נדרגארד משערת שבכל פעם שתא אנדותל מת, אם בעקבות פציעה ואם באופן טבעי, נפער פתח ארעי במחסום הדם-מוח. תאי האנדותל הסמוכים אינם יכולים לסגור את הפתח באופן מידי, שכן הם מחוברים זה לזה בצמתים בין-תאיים הדוקים (מִצְמָתים בין-תאיים). העובדה שסדקים כאלה נפתחים מדי פעם במחסום הדם-מוח מחייבת את קיומו של קו הגנה אחר שיאפשר את סתימת המחסום באופן מידי ואת המשך תפקודו התקין של המוח. בסדרה של ניסויים פרצה נדרגארד את נימי הדם במוחם של עכברים חיים בקרן לייזר. בתוך 10 עד 20 דקות, היא אומרת, תאי המיקרוגְלִייה עטפו באופן הדוק את האזור הפגוע. "הם כיסו את האזור במהירות שלא תיאמן, למעשה, זה היה מראה יפה מאוד."
קבוצת המחקר שלה מנסה כעת לגלות אם אכן תאי המיקרוגְלִייה הם קו ההגנה הראשון בהגנה על מחסום הדם-מוח, צוות החירום שמגיע במהירות וסותם את הפרצה עד שיוחלפו או יתוקנו תאי האנדותל הפגועים. "אפשר לתאר," אומרת נדרגארד "מצב בו שתאי המיקרוגְלִייה אינם מתפקדים באופן תקין ולפיכך אינם סותמים את הפרצות במחסום הדם-מוח במהירות מספקת, דבר שמוביל לניוונם של תאי העצב.” השערה זו שלה היא רק אחת מבין השערות רבות אחרות שבוחנים כיום מדענים כדי לגלות את הקשר שבין תפקוד מחסום הדם-מוח לבין מחלות שונות.
לדוגמה, טרשת נפוצה, מחלה המאופיינת באירועים של כאבי שרירים מתישים, היעדר תחושה ובעיות ראייה. רופאים יודעים כבר עשרות שנים שטרשת נפוצה נגרמת מפירוק של רקמת המיאלין, רקמה גמישה שעוטפת את האקסונים ("חוטי החשמל" של המוח) ויוצרת סביבם שכבת בידוד חשמלית ממש כמו שכבת הגומי שמבודדת את חוטי הטלפון. אך עדיין אין תשובה לשאלה מדוע המחלה מתפרצת בהתקפים, ומה גורם להתפרצויות. עדויות שונות שנצברו בעזרת דימות תהודה מגנטית (MRI) מרמזות שפריצת מחסום הדם-מוח מזרזת התקפות של טרשת נפוצה. הפריצות החריגות במחסום מאפשרות לכמות גדולה של תאי דם לבנים לחדור לתוך המוח ולתקוף את שכבת המיאלין. מדענים סבורים כעת, בהתבסס על כמה ניסויים חדשים, שמולקולות חמצן פעילות תוקפות את מחסום הדם-מוח ומחלישות אותו. חומרים נוגדי חמצון יכולים אפוא לעצור את התופעה ולייצב את המחסום. “תמיד חשבנו שטרשת נפוצה היא מחלה של המערכת החיסונית,” אומר דְרֶוֶוס. “כעת אנחנו מתחילים לחשוב עליה כעל מחלה של מחסום הדם-מוח.”
שינוי תפיסתי דומה נוגע לאפילפסיה (כפיון). מדענים ורופאים יודעים זה זמן רב שהתקפי כפיון באים בעת ובעונה אחת עם פריצות במחסום הדם-מוח, אך עד לאחרונה הפריצות האלה נחשבו לתוצאה ולא לסיבה של התקפי הכפיון. צורת חשיבה זו מתחילה כיום להשתנות. מדענים מאוניברסיטת אמסטרדם גילו שיצירת פרצות מלאכותיות במחסום הדם-מוח של חולדות היא דרך מהימנה להעלות את מספר התקפי הכפיון שמהם יסבלו החולדות, ושככל שאירועי הפריצה המלאכותיים של המחסום רבים יותר, עולה ההסתברות שהחולדה תסבול מהתקף כפיון של האונה הרקתית. מחקרים שנערכו במרפאת קליבלנד הראו שהן אצל חזירים (באופן ניסיוני) והן בקרב אנשים (על פי תצפיות) פריצת מחסום הדם-מוח מתרחשת לפני, ולא אחרי, התקף הכפיון.
בתחום אחר, מדענים מצאו שני חלבונים שתפקוד בלתי תקין שלהם יכול למלא תפקיד במחלת אלצהיימר. חלבון אחד (המכונה RAGE) מוביל את מולקולות הבֶּטָא אַמילואיד ממערכת הדם אל המוח, בעוד שהחלבון השני (המכונה LRP1) מסלק אותן מן המוח. כשמופר שיווי המשקל בין פעילותם של שני החלבונים האלה, הבטא אמילואיד מצטבר במוח ונוצרים משקעים המאפיינים את מחלת אלצהיימר. על אף שפיתוחן של תרופות על בסיס הממצאים האלה עדיין רחוק, הם מעניקים בכל זאת בדל של תקווה. מדענים הצליחו למנוע את התפתחותם של משקעי בטא אמילואיד בעכברים על ידי עיכוב פעילותו של הגן לחלבון RAGE בתאי אנדותל. יש אפשרות שתרופות המדכאות את פעילותו של החלבון הזה (תרופות שמפותחות כעת) יוליכו לתוצאה דומה אצל בני אדם.
ואולם, תיקון דליפות במחסום הדם-מוח הוא רק חציו האחד של האתגר המדעי. חציו השני הוא פיתוחם של אמצעים לפרוץ את המחסום באופן מכוון כדי להחדיר תרופות היישר אל המוח. נכון להיום, רופאים מצאו לפחות שיטה מוכחת אחת לבצע זאת, והמירוץ למציאת שיטות נוספות, רבות ככל האפשר, עדיין נמשך.
סומסום היפתח
על אף מורכבותו של מחסום הדם-מוח, מעבר חומרים בין הדם לבין המוח נקבע על פי מערכת כללים פשוטה להפליא. כדי לחצות את המחסום על מולקולה להיות קטנה מ-500 קילו-דלטון (כמו רוב התרופות האנטי-דיכאוניות, התרופות האנטי-פסיכוטיות ותרופות השינה), להיות בעלת מבנה המאפשר לה לחצות את המחסום בעזרת אחד מדרכי המעבר הטבעיות של המערכת (כמו התרופה לפרקינסון אל-דופה), או להיות ליפופילית, כלומר להיות בעלת תכונה כימית המאפשרת לה לחדור לתוך החלק ההידרופובי של קרום תאי האפיתל (כמו אלכוהול, קפאין והרואין). על פי רוב ההערכות, 98% מן התרופות המוכרות אינן עומדות בקריטריונים האלה, כלומר או שהן חודרות למוח בכמות קטנה מדי וחסרת תועלת מבחינה רפואית, או שהן אינן חודרות כלל אל המוח.
ניסיונות העבר לנצל את מערכת הכללים הזאת נכשלו רובם. למשל, הגברת מסיסותן של תרופות בשומן אפשרה להן אמנם לחדור את מחסום הדם-מוח בקלות גדולה באופן יחסי, אך מהר מאוד גילו המדענים שלאסטרטגיה זו יש גם כמה חסרונות חשובים. מקצת התרופות אמנם חדרו למוח אבל גורמים שונים אחרים המצויים במוח הוציאו אותם מיד בחזרה למחזור הדם. תרופות אחרות נתקעו על גבי קרומי התא של תאי האנדותל ולא הצליחו לחדור אל המוח ולבצע את תפקידן. אך חמור מכך, כולן חדרו גם לכל שאר האיברים בגוף ללא הבחנה.
לפני כ-30 שנה, כשהיה רופא מתמחה, החליט אדוארד א' נוֹיוֶולט לחפש אסטרטגיה אחרת. נויוולט, נוירוכירורג ומנהל התכנית ללימודי מחסום הדם-מוח באוניברסיטת אורגון למדע ולרפואה, פיתח את ההליך הכירורגי הראשון לפריצה של המחסום. בשלב הראשון הוא הזריק לעורקים המובילים אל המוח תמיסה של חומר המכונה מַניטוֹל. מכיוון שמַניטול הוא חומר היפֶּראוֹסמוֹטי, כלומר תמיסה שמכילה הרבה יותר מומסים מאשר הנוזל התוך תאי של תאי האנדותל, הוא גורם למעבר של הנוזלים מתאי האנדותל אל מחזור הדם וכתוצאה מכך להצטמקותם של תאי האנדותל, ממש כמו אצבעות שהושרו במים לפרק זמן ממושך. בעקבות זאת, המצמתים הבין-תאיים נפתחים ומשאירים פתח רחב דיו למעבר של תרופות המוחדרות למוח דרך אותו עורק. כעבור 40 דקות עד שעתיים תאי האנדותל חוזרים ומתרחבים לגודלם הטבעי, יוצרים מחדש את המצמתים הבין-תאיים ואוטמים מחדש את המחסום.
במשך כעשרים שנה משתמש נויוולט בהליך הזה כדי לפרוץ את מחסום הדם-מוח אצל חולים מסוג מיוחד: בעלי גידולים סרטניים במוח שצפויים להגיב לכימותרפיה לו רק הייתה זו מצליחה לחדור אל הגידול.
אחת מן המטופלות האלה היא ג'ואני לפרטי, אם לשלושה בת 57 שאובחנה ב-2007 כחולה בלימפומה של מערכת העצבים המרכזית (סרטן הפורץ במערכת הלימפה וחודר למערכת העצבים המרכזית). הרופאים נתנו לה כחודש לחיות. כשהגיעה בפעם הראשונה לאוניברסיטת אורגון, שבועיים אחרי שנלקחה ממוחה הביופסיה, כבר היה צדו הימני של גופה משותק. חברת הביטוח שלה הזהירה אותה מפני ההליך הכירורגי בטענה שהוא עדיין ניסיוני ויכול לגרום לאפילפסיה ממושכת, שבץ או חמור מזה. אבל ללפרטי לא היה מה להפסיד. "זו הייתה ההצעה היחידה שהונחה על השולחן,” היא אומרת. "ואני רציתי לחיות."
כך יצא שרק כמה שבועות חלפו מאז שאובחנה לפרטי כחולה עד ששכבה על שולחן הניתוחים של נויוולט וצוותו ואפשרה להם להחדיר צנתר דרך המפשעה שלה עד לעורק התרדמני השמאלי ולהזרים בצינור הצנתור שתי תמיסות, תחילה את תמיסת מניטול היפראוסמוטית ואחריה במהירות את התרופה הכימותרפית מֶתוֹטְרֶקְסַט. למחרת הם חזרו על התהליך בעזרת העורק התרדמני הימני שלה. נויוולט וצוותו חזרו על הפרוטוקול במרווחים של חודש במשך שנה. תחילה דרך העורק התרדמני השמאלי ואחר כך דרך העורק התרדמני הימני. המניטול יצר סדקים במחסום הדם-מוח של לפרטי כדי שהתרופה תוכל לחדור ולתקוף את הגידול במוחה. בסופו של המחזור השני של הטיפול, הצליחה לפרטי לצאת מבית החולים בלי כיסא הגלגלים שלה. כעבור חודשיים נעלם הגידול. כעבור חמש שנים היא עדיין חיה.
בעבור חולים בני פחות מ-60 הטיפול של נויוולט מאריך את תוחלת החיים הממוצעת שלהם ב-13 עד 14 שנה עם תוצאות קוגניטיביות טובות בהרבה מאלו המתקבלות לאחר טיפולי הקרנות כלל-מוחיים (ויש לזכור שלא בכל הגידולים אפשר לטפל בעזרת הקרנות). נכון, אי אפשר להעביר את כל התרופות הכימותרפיות דרך מחסום הדם-מוח בצורה זו, ואי אפשר לטפל בכל סוגי הסרטן בעזרת פרוטוקול טיפול זה. כיום, רק מעט תרופות נבדקו ונמצאו בטוחות לשימוש בעזרת שיטתו של נויוולט. מכיוון שבמהלך הטיפול מוזרם מניטול מן העורקים לכל רחבי המוח, נפרץ מרבית מחסום הדם-מוח, ולכן יש סיכונים כמו התנפחות של הרקמות, הרעלה וזיהום.
בזמן שניוולט וצוותו משכללים את פרוטוקול הטיפול שלהם ומנסים להרחיב את היישומים שלו, רופאים ברחבי העולם מחפשים טיפולים חלופיים. אחת החלופות המבטיחות ביותר היא שימוש במיקרו-צנתר. בדומה לטכניקת פריצת מחסום הדם-מוח של ניוולט, גם צורת טיפול זו כוללת החדרה של צנתר לכלי הדם ושימוש במניטול כדי לפרוץ את מחסום הדם-מוח. ואולם, במקום לעצור בעורק התרדמני, המיקרו-צנתר חודר כל הדרך עד למוח ופותח את מחסום הדם-מוח באזור מוגבל מאוד סמוך לאזור שבו מצוי הגידול הפתולוגי. "זהו הליך מדויק מאוד,” אומר ג'ון בוקוור, נוירוכירורג מן המרכז הרפואי הפרסביטריאני בניו יורק על שם וויל קורנל, המנהל את הניסויים הקליניים במיקרו-צנתור.
עדיין לא ברור אם בטיפול זה יש משום יתרון או חיסרון. מצד אחד, פריצה של מחסום הדם-מוח באזור מצומצם מפחיתה את הסיכון להתנפחות של הרקמות ולהתקפי כפיון, ואין צורך לומר שרק חלק קטן מן המוח נחשף לתרופות הכימותרפיות הרעילות. מצד אחר, כפי שמציין נויוולט, התמקדות באזור מוגבל של המוח יש בה משום חיסרון בטיפול במחלות כלל-מוחיות כמו סרטן או אלצהיימר מתקדם. בעזרת מיקרו-צנתור אתה תוקף רק את מה שאתה רואה,” הוא אומר.” אך בייחוד בגידולים מוחיים, אלו הן דווקא הגרורות הקטנות והבלתי נראות שגורמות בסופו של דבר למותו של החולה.”
כיום נעשה שימוש במיקרו-צנתור באופן שגרתי כדי להחדיר היישר למוח תרופות נוגדות קרישה לחולים שעברו שבץ מוחי. בוקוור וצוותו בודקים כעת את יעילות התהליך בהחדרת כמה תרופות לסרטן. בסופו של דבר, הם אומרים, יהיה אפשר לעשות שימוש בטכנולוגיה זו כדי לטפל במחלות כמו אלצהיימר, פרקינסון או באופן תיאורטי בכל מחלת מוח שיש בשבילה תרופה שאינה יכולה לעבור את מחסום הדם-מוח ללא עזרה.
אסטרטגיה אחרת הננקטת כדי לפרוץ את המחסום משתמשת בגלי אולטרסאונד ממוקדים ובבועות מיקרוסקופיות. חוקרים מזריקים למחזור הדם תמיסת מלח שמכילה בועות מיקרוסקופיות. לאחר מכן הם משתמשים באלומת גלי אולטרסאונד ממוקדת שגורמת לבועות לרטוט במהירות ולפרוץ את מחסום הדם-מוח במקום מוגדר ומדויק. בעקבות זאת, תרופות שמוזרקות גם כן למחזור הדם יכולות לחדור לתוך המוח. זמן מה אחרי הטיפול המצמתים הבין-תאיים נוצרים מחדש וחוסמים שוב את מחסום הדם-מוח. חוקרים מאוניברסיטאות הרווארד וקולומביה וממוסדות מחקר אחרים מפתחים כעת את הטכנולוגיה הזאת. ניסויים שנערכו בקופים הראו שהטכנולוגיה בטוחה, ולאור זאת מתוכננים בעתיד הקרוב ניסויים בבני אדם.
כמובן, פריצה של מחסום הדם-מוח אינה הדרך היחידה להחדיר תרופות למוח. שיטה אחרת היא להגניב אותן דרך המחסום על ידי קישורן לחומרים שעוברים את המחסום באופן טבעי. חוקרים שמפתחים תרופות אלה מכנים אותם בשם סוסים טרויאנים. במידה מסוימת זהו שם לא הולם. התרופה אינה מוחבאת בתוך החומר הטבעי, אלא קשורה אליו בקצה כמו עגלה רתומה. השיטה פועלת במקרים מסוימים. סוס טרויאני שפיתחה חברת ג'ננטק הצליח להפחית ב-47% את כמות משקעי האמילואיד במוחם של מכרסמים. התרופה הזאת חודרת למוח בעזרת אותם קולטנים שאחראיים למעבר של יוני ברזל. חוקרים מפתחים כיום תרופות דומות (לא רק לאלצהיימר אלא גם למחלות מוח ניווניות אחרות) באוניברסיטת קליפורניה בלוס אנג'לס ובמקומות אחרים, וכולם מתקדמים באטיות לעבר אותו היעד: ניסויים בבני אדם.
אלפא ואומגה
בינתיים, ממצאים חדשים מעידים על חשיבותו של מחסום הדם-מוח לא רק בהתפתחותן של מחלות אלא גם בתהליכים ביולוגיים מהותיים כמו תהליכי התפתחות והזדקנות: תחילתם וסופם של החיים עצמם. ניסויים שנעשו בשנות ה-20 של המאה ה-20 העלו שהמחסום בשל כבר בתינוקות שאך נולדו, והסברה הזאת מקובלת על ביולוגים התפתחותיים וחוקרי מחסום הדם-מוח עד היום. עם זאת, מחקרים עכשוויים מראים שהמצמתים הבין-תאיים נוצרים כמעט באותו זמן שבו כלי הדם גדלים לתוך המוח העוברי. למעשה, חוקרים מתחילים לחשוב שהמחסום ממלא תפקיד מרכזי במהלך ההתפתחות העוברית ביצירת סביבה מוגנת שרק בה יכולים תאי העצב להתפתח ולהתחבר באופן נאות.
אחר כך, כשאנחנו מזדקנים, הסביבה המוגנת הזאת מתחילה להיפרץ. חוקרים מתחילים לחשוד ששינויים עדינים במחסום הדם-מוח, אולי ארגון מחדש של מערכת כלי הדם המוחית או שמא דליפות קטנות במחסום עצמו, הם שסוללים את הדרך לצורות השונות של המחלות הניווניות של מערכת העצבים המופיעות עם ההזדקנות. "זה הדבר הגדול הבא שעלינו לבחון,” אומר דְרֶוֶוס החוקר את המחסום כבר יותר מ-20 שנה. "ייתכן שהלקח שאנחנו צריכים ללמוד הוא כמה מעט בעצם אנו מבינים.”
___________________________________________________________________________________________________________________________________________________________________
על המחברת
ג'נן אינטרלנדי (Interlandi) היא עיתונאית מדע המתגוררת בעיר ניו יורק. את השנה האחרונה בילתה בלימודי היסטוריה של המדע ושל הרפואה כעמיתה בתכנית על שם נימן באוניברסיטת הרווארד.
בקיצור
במשך יותר ממאה שנים סברו מדענים כי מחסום הדם-מוח הוא מחסום קשיח ובלתי חדיר. למעשה, הוא עשוי מכלי דם רגילים בעלי תכונה מיוחדת אחת: רקמת התאים המרפדת את כלי הדם האלה מאורגנת באופן הדוק ביותר המאפשר רק למספר קטן של סוגי מולקולות לחדור לתוך רקמת המוח.
המחסום הוא איבר חיוני כשהוא לעצמו, ההומה מפעילות. התאים השונים המרכיבים אותו מתקשרים זה עם זה על בסיס קבוע כדי לקבוע אילו מולקולות לחסום ואילו להעביר. למעשה, מספר התאים העוברים מצדו האחד של המחסום לצדו האחר גדול בהרבה ממה ששיערו בעבר.
כדי לשקף את התפיסה החדשה בהבנת מחסום הדם-מוח החלו מדענים לכנותו בשם היחידה הנוירו-וסקולרית.
רבים סבורים שאם נבין כיצד לפתוח את המחסום ולסגור אותו נוכל להחזיק את המפתח לריפוי מחלות הקשורות במערכת העצבים המרכזית.
כיצד זה עובד
קרדיט: אמילי קופר
לחצות את הגבול
בזמן שמחסום הדם-מוח מגן על המוח מפני חומרים מזיקים הוא גם מונע את כניסתם של חומרים שיכולים להיות מצילי חיים. החדרתן של תרופות למוח כדי לטפל בגידולים סרטניים או כדי לבדוק את יעילותן בטיפול בפרקינסון העמידה אתגר מיוחד לרופאים במשך הרבה מאוד שנים. היום בודקים חוקרים טכנולוגיות חדשות ומבטיחות שיאפשרו להם לבצע את מה שבעבר נחשב לכמעט בלתי אפשרי: לפרוץ את מחסום הדם-מוח בלי לפגוע בתפקודו התקין של המוח, ולעשות זאת בדיוק לפרק הזמן הדרוש כדי להחדיר אל המוח את התרופות.
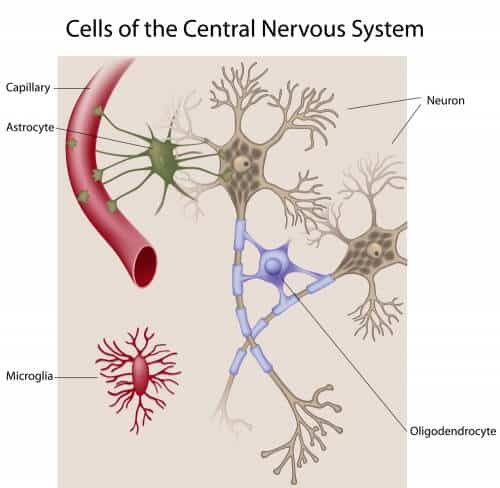
מחסום הדם-מוח
המחסום עשוי מתאי אנדותל שמצפים את כלי הדם. במוח, התאים האלה מחוברים זה לזה באופן הדוק במיוחד במִצְמָתים בין-תאיים. את תאי האנדותל מקיפים אַסטרוציטים ופֶּריציטים, תאים העוטפים את כלי הדם ועשויים לאפשר תקשורת בין תאית. סביבם חגים תאי מיקרוגְלִייה שמשתתפים בתיקון נזקים הנגרמים למחסום הדם-מוח.
סוסים טרויאנים
אמנם השם מרמז על תרופות המוחבאות בתוך חומרים אחרים, אבל אלו הן למעשה תרופות שמחוברות לקצה של מולקולות המסוגלות לעבור את מחסום הדם-מוח באופן טבעי, בדומה לנגרר של מכונית. חברת התרופות ג'ננטק הראתה שתרופות כאלה פועלות על עכברים, אך יחלפו כמה שנים עד שיחלו ניסויים קליניים בבני אדם.
בועות מיקרוסקופיות
סודה בדם? רופאים מזריקים לחולים תמיסת מלח שמכילה בועות גז מיקרוסקופיות. כשהבועות מגיעות למוח, קרן אולטרסאונד ממוקדת גורמת להן לרטוט באופן שמוביל לפתיחת המחסום ומאפשר לתרופות לחדור לתוך המוח.
מיקרו-צנתר
רופאים מחדירים צנתר זעיר דרך כלי הדם עד למוח ומשתמשים בתמיסת מַניטול כדי לפתוח פתח זעיר במחסום הדם-מוח סמוך למקום שבו הם מבקשים לטפל. לאחר מכן הם מזריקים את התרופה דרך אותו צנתר. שיטה זו מצויה כבר היום בשימוש במקרים שבהם יש להחדיר למוח תרופות נוגדות קרישה עקב שבץ מוחי.
תמיסות היפר-אוסמוטיות
תמיסות מסוימות כמו מַניטול יכולות לשאוב נוזלים מן הרקמות הסמוכות. כשרופאים מזריקים את תמיסת המניטול לעורק המוביל למוח הוא סופג מים מתאי האנדותל וגורם להם להתכווץ. בעקבות זאת, המִצְמָתים הבין-תאיים נפתחים ותרופות יכולות לחדור לתוך המוח.
לעבור דרך המחסום
מדעני מוח סברו בעבר שמסוכן מדי להתערב בפעילתו של מחסום הדם-מוח. היום הם משתמשים בצנתרים, בבועות זעירות, בגלי אולטרסאונד, ואפילו בתחבולה הקרויה על שם סצנה מפורסמת באיניאדה של וירגיליוס, כדי להחדיר תרופות דרך מחסום הדם-מוח.
הכתבה מתפרסמת באישור סיינטיפיק אמריקן ישראל

5 תגובות
מאמר מעניין ,תודה.
כל המחלות כולל תהליך ההזקנות מונעים מהמנגנון הגנטי. בשלב השני אני מניח, יוכלו להשתמש במעבר במחסום דם-מוח לתיקון יסודי לתיקון הגנים הלקויים בהנדסה גנטית.גם תיקון ואף שיפור מחסום דם-מוח במקרים בהם הוא נפרץ או חדיר יותר בהשוואה לממוצע יסייעות במניעת חדירה של גורמים עויינים לתוך קליפת המוח. ברמה המחקרית של תפקוד ולימוד פעילות המוח, מחסום דם-מוח הוא אף אמצעי מחקרי.
טעות שלי, סליחה אם קפצתי מוקדם מדי (או שהניסוח הקודם תוקן)
"הוא מערכת דינמית ופעילה יכולים להביא למהפכה"
איזה ניסוח – ממש עברית תקנית, חבל שלא עוברים על כתבות כאן לפני פרסומן.
מאמר מעניין מאוד! תודה!
מרתק