זוהו החלבונים והמנגנונים הנדרשים למאבק בהצטברויות החלבוניות שמובילות למחלות ניווניות-עצביות
חלבוני הגוף מתפקדים ופועלים בזכות הומאוסטזיס בתאים – מצב שבו נשמרים התנאים הפיזיקליים והכימיים שמתאימים לתפקודם ולפעילותם, למרות שינויים בסביבתם החיצונית. פרופ’ רעות שלגי מהפקולטה לרפואה בטכניון חוקרת יחד עם צוותה, באמצעות ביולוגיה מולקולרית וחישובית, כיצד תאי הגוף שומרים על הומאוסטזיס חלבוני במצב נורמלי ובמצבי סטרס (דחק) סביבתיים או פיזיולוגיים.
“במצבי דחק התאים צריכים להגיב מהר מאוד כדי למנוע פגיעה בעצמם ובחלבונים”, אומרת פרופ’ שלגי. “לרוב הם עושים זאת היטב כי הם מתוכנתים לכך אבולוציונית. אך כאשר הם נפגעים (למשל ממוטציה) ולא עושים זאת, מתפתחות מחלות. כך למשל, רוב המחלות הנוירודגנרטיביות (ניווניות עצביות), כגון אלצהיימר, פרקינסון, הנטינגטון ו-ALS, נגרמות בשל בעיות בקיפול החלבונים – התארגנות שרשרות חומצות האמינו שמרכיבות אותם לכדי מבנה תלת-ממדי. כלומר, החלבונים גורמי המחלה מתקפלים לא נכון, נדבקים זה לזה ויוצרים הצטברויות (אגרגציה) ששוקעות בתאי עצב והורסות אותם. אם נבין כיצד ניתן למנוע את המצב הזה, ייתכן שנוכל להיאבק טוב יותר במחלות הללו”.
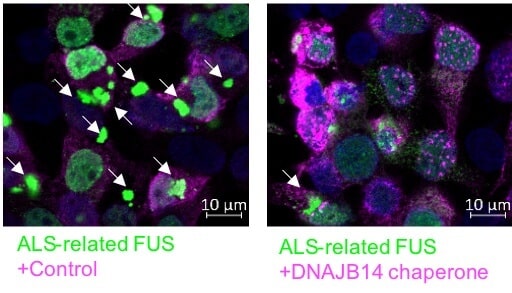
לשם כך מדמים פרופ’ שלגי וצוותה תנאי דחק בתאים במעבדתם ובוחנים את תגובתם המערכתית. למשל, מה קורה לגנים שבהם, אילו מהם מתבטאים, אילו חלבונים מתורגמים מהם ואילו שינויים חלים בקיפולם. במחקר האחרון, שזכה במענק מחקר מהקרן הלאומית למדע, ביטאו הדוקטורנטיות כנרת רוזלס ואמל יוניס (מובילות המחקר) ופרופ’ שלגי, בתרביות של תאים אנושיים, את החלבון HTT עם מוטציה שגורמת להנטינגטון ואת החלבון FUS עם מוטציה שגורמת ל-ALS.
הנטינגטון היא מחלה גנטית שמאופיינת בהפרעות מוטוריות, קוגניטיביות ופסיכיאטריות ו-ALS היא מחלת ניוון שרירים סופנית. במחלות אלה החלבונים HTT ו-FUS נפגעים כתוצאה ממוטציה וכך קיפולם נפגע והם נדבקים ומייצרים את ההצטברויות שהורסות את תאי העצב. מטרת החוקרות הייתה לבחון את תגובת התאים להצטברויות, ולהבין כיצד ניתן לסייע להם במניעתן.
לשם כך בחנו החוקרות את בקרת הביטוי הגנטי בתאים באמצעות ריצוף כלל גנומי, וגילו כי אלו עם החלבון HTT הגיבו להצטברויותיו באמצעות העלאת רמת השפרונים שמיועדים להתמודדות עם עקת חום (שגם היא גורמת לבעיות בקיפול חלבונים). שפרונים הם משפחה של חלבונים “מלווים” שאחראיים לקיפול תקין של חלבונים בתאים ולזיהוי בעלי הקיפול השגוי ושליחתם לדגרדציה (פירוק). בתאים עם ההצטברויות של חלבון FUS הן גילו כי רמת השפרונים דווקא ירדה. בהמשך לכך ביקשו לדעת אם העלייה או הירידה ברמת השפרונים היא מכוונת ומותאמת למאבק בהצטברויות. לשם כך ביצעו סריקה שבה ביטאו בשיטות גנטיות 70 שפרונים שונים (כל פעם שפרון אחד) באותם התאים. כך גילו שרק מעטים מהם באמת עוזרים לתאים להיאבק בקיפול החלבונים השגוי, ואלו שעוזרים בכך משתנים בין שתי המחלות.
פרופ’ שלגי: “לראשונה זיהינו בתאים אנושיים את השפרונים הספציפיים הנדרשים למאבק בחלבונים שגורמים להנטינגטון ו-ALS. כאשר ביטאנו אותם ביתר בתאים, החלבונים התקפלו באופן תקין וההצטברויות נמנעו. אם נמצא דרך לגרום להם לבטא את השפרונים האלה ביתר, נוכל אולי למנוע את הידרדרות המחלות”.
בהמשך נמצא שהשפרונים שמנעו את ההצטברויות של ALS עשו את ההפך עם HTT – כלומר האיצו את הצטברויותיו. ממצאים אלה מעידים כי אותם שפרונים, בגרסאות שונות, מובילים לתוצאות הפוכות בהנטינגטון ו-ALS. מכאן ניתן להסיק כי בעיות הקיפול שגורמות למחלות אלו הן שונות ביותר ומצריכות סט כלים ספציפי למאבק בהן. “ממצאינו הם צעד ראשון להגדרת המאבק במחלות האלו, למניעת קיפול החלבונים השגוי שגורם להן. הצעד הבא הוא להבין כיצד לגרום לתאים לבטא ביתר את השפרונים הספציפיים הנדרשים להם”, מסכמת פרופ’ שלגי.
החיים עצמם:
פרופ’ רעות שלגי, 43, נשואה פלוס שני ילדים (10 ושנתיים), ומתגוררת בחיפה (“מתוקף היותי אמא ומדענית, לא נשאר לי הרבה זמן פנוי לתחביבים”).
עוד בנושא באתר הידען:
