חקר תאי הגזע הוא אחד התחומים ה"חמים" במחקר הביולוגי והרפואי כיום. לאחר עשור של תגליות שהביאו את החוקרים להבנה טובה יותר של פעילות תאי הגזע בעובר המתפתח ובגופו של אדם בוגר, אנו נמצאים כעת על סיפו של עידן חדש ברפואה, עידן שבו נוכל לנסות לטפל בחולים הלוקים במגוון רחב של מחלות שהרפואה המודרנית עדיין אינה יודעת להתמודד עמן
פוטנציאל בלתי מוגבל
תאי גזע הם תאים שטרם עברו תהליכי התמיינות סופיים, כלומר תאים שעדיין יש להם פוטנציאל להפוך לתאים מסוג אחר. עובר בן ימים ספורים מורכב אך ורק מתאי גזע, ובהמשך ההיריון, כשמתחילים להיבנות איברי הגוף, שיעורם היחסי הולך וקטֵן. עם זאת, ניתן למצוא תאי גזע בשלבי התמיינות שונים גם בתינוק המגיח מבטן אמו וגם באדם הבוגר.
מאפיין חשוב נוסף של תאי גזע הוא יכולת החלוקה הבלתי מוגבלת שלהם, הנובעת גם מביטוי גבוה של טלומראז. בתנאים מתאימים, תאים אלו ימשיכו להתחלק לנצח ויעמידו דור אחר דור של תאי גזע; ובתנאים אחרים, המצויים למשל בעובר המתפתח, מרבית תאי הגזע מתמיינים ויוצרים תאים ספציפיים הבונים את הרקמות השונות. לאחר הלידה תאי הגזע ממשיכים לשמש כמאגר ליצירת תאים חדשים, והם מתמיינים בהתאם לצורך ומחליפים תאים פגומים או מתים. לתאי גזע שונים פוטנציאל התמיינות שונה: תאי הגזע הראשוניים בעובר יכולים להפוך בסופו של דבר, לאחר סדרת תהליכי התמיינות, לכל אחד מלמעלה ממאתיים סוגי התאים בגוף האדם הבוגר וכן לתאי רקמות חוץ-עובריות, כגון השליה. תאי גזע אחרים מוגבלים ביכולת ההתמיינות שלהם, ומסוגלים להפוך רק לתאים מסוגים אחדים או מסוג אחד בלבד.
השתלת מוח עצם היא למעשה השתלה של תאי גזע המטופויאטיים (hematopoietic), כלומר תאי גזע שעברו התמיינות חלקית וכעת מסוגלים להתפתח לתאי דם מכל הסוגים. השתלה כזו מקובלת זה שנים כטיפול למחלות דם רבות, ולמחלות נוספות שבהן יש צורך לשקם את מערכת הדם ואת המערכת החיסונית לאחר הטיפול הרפואי (ראו מאמרנו "תאי גזע בשירות הרפואה" בקרוב).
כיום שואפים החוקרים לגדל במעבדה תאי גזע בכמות מספקת, שיוכלו לשמש כמקור למגוון סוגי תאים אשר יושתלו בגופם של חולים ויספקו מרפא למחלות רבות נוספות. מציאת דרכים ליצור תאים מתאימים להשתלה מוצלחת ובטוחה היא מטרה ראשית של המחקר בתאי גזע בימינו. נוסף על השתלות מוח עצם, תאי גזע משמשים עוד למגוון מטרות: גידולם כתרבית תאים לבדיקת פעולת תרופות; חקר מחלות גנטיות באמצעות תאי גזע בעלי פגמים גנטיים; חקר סוגי סרטן הנגרמים על ידי תאי גזע פגומים; חקר תהליכי ריפוי טבעיים בגוף; ולימוד בסיסי של מנגנוני התמיינות תאי הגזע ושל התפתחות העובר מביצית בודדת לאורגניזם שלם.
במאמר זה נעסוק בתפקידם של תאי הגזע בגוף, בהיסטוריה של חקר תאי הגזע, בשיטות המחקר המשמשות בתחום מרתק זה ובסוגיות הביו-אתיות שהוא מעורר.
מביצית לאדם
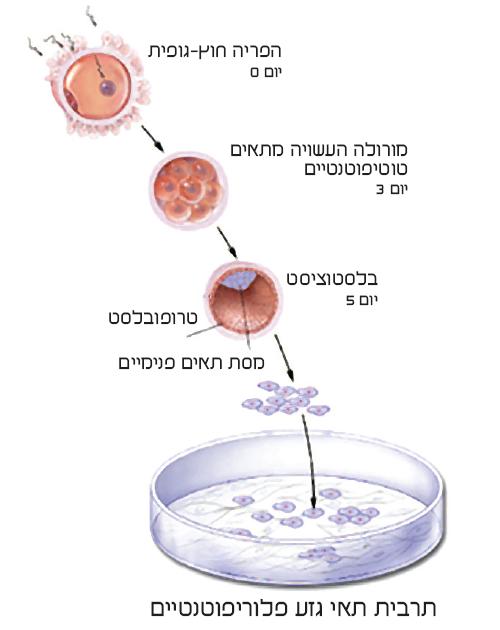
מקורם של תאי הגוף בביצית מופרית, הזיגוטה, שהיא תא הגזע הראשי שממנו יתפתח העובר במהלך ההיריון. לאחר ההפריה, מתחילה הזיגוטה להתחלק, ובתוך ימים מספר נוצר צבר של עשרות תאים שעדיין מהווים תאי גזע בעלי פוטנציאל ההתמיינות הגבוה ביותר.
תאים אלו, הקרויים תאי גזע טוטיפוטנטיים (totipotent), יכולים להפוך במהלך ההתמיינות לכל תא בגוף, וכן לתאים חוץ-עובריים, כגון תאי השליה. צבר התאים, הנקרא מורולה (morula), לובש צורה של כדור חלול לקראת היום החמישי להיריון. הכדור החלול, הבלסטוציסט (blastocyst), העשוי בשלב זה מכ-100 תאים, מורכב ממעטפת ומאוסף תאים פנימיים הצמודים לה באזור מצומצם. שכבת המעטפת, הטרוֹפוֹבּלַסט (trophoblast), תהפוך לשליה עם השרשתו של הבלסטוציסט ברירית הרחם ימים ספורים אחר כך, ואילו התאים הנמצאים בתוך הבלסטוציסט יהפכו לעובר עצמו. מסת תאים פנימיים זו (inner cell mass) מורכבת מתאי גזע בעלי פוטנציאל התמיינות גבוה מאוד, והם מהווים מקור לכל תאי הגוף באדם הבוגר. תאים אלו קרויים תאי גזע פלוריפוטנטיים (pluripotent), ולהם חשיבות גדולה בחקר תאי הגזע.
ההתמיינות הראשונה של תאי הגזע הפלוריפוטנטיים מתחילה בסוף השבוע השני להיריון, בתהליך הקרוי גסטרולציה (gastrulation). אז נוצרות בעובר, שצורתו בשלב זה דומה לדיסקה, שלוש שכבות תאים. אלו הן שכבות הנבט (germ layers) המהוות מקור לרקמות הגוף השונות המתפתחות בעובר בהמשך ההיריון. המוח, מערכת העצבים, איברי החישה והעור מתפתחים מהשכבה החיצונית (ectoderm); השלד, השרירים, רקמות החיבור ומערכת הדם מתפתחים משכבת הביניים (mesoderm); ואילו מערכת העיכול ומערכת הנשימה מתפתחות מהשכבה הפנימית (endoderm). תאי הגזע הבונים את שכבות הנבט הם תאי גזע מולטיפוטנטיים (multipotent), כלומר תאי גזע היכולים להתמיין לקבוצות של תאים, אבל אף אחד מהם אינו יכול להוות מקור לעובר שלם.
בהמשך, תאים אלו עוברים שלבי התמיינות אחדים. מקצתם הופכים לתאים ספציפיים ברקמות השונות, ואילו אחרים ממשיכים להתרבות כתאי גזע גם לאחר הלידה. תאים אלו הם מאגר תאי הגזע הסומטיים (somatic) שבגופו של אדם בוגר. בעת הצורך, תאי הגזע הסומטיים נכנסים למסלול התמיינות שבסופו נוצרים תאים ספציפיים. תא שנכנס למסלול התמיינות, ואינו יכול אפוא להמשיך להתחלק לנצח, נקרא תא אב מחויב (committed progenitor cell) והוא משמש מקור לקבוצת תאים מסוג אחד או מסוגים בודדים. תאי הגזע ההמטופויאטיים, המסוגלים להתמיין לסוגים השונים של תאי דם ותאי מערכת החיסון, הם דוגמה לתאי גזע סומטיים העשויים בעת הצורך להתמיין לתאי אב מחויבים ומהם לתאי הדם השונים. תאים אלו מופיעים בכמות גדולה יחסית בדם הטבורי שאותו ניתן לאסוף בעת הלידה, וכן הם נמצאים באופן קבוע במוח העצם של אדם בוגר. כמותם גדולה יחסית בגלל הצורך של הגוף לחדש את מלאי תאי הדם השונים. באותו אופן, כמות תאי הגזע במעיים גדולה יחסית באדם בוגר. לעומת זאת, כמות תאי הגזע היכולים להתמיין לתאי שריר הלב או לתאי עצב נמוכה, ולכן פגיעה באיברים אלו עלולה להיות בלתי הפיכה.
לתאי הגזע הסומטיים יכולת התמיינות נמוכה יחסית, והם מסוגלים להתמיין בדרך כלל למספר קטן של סוגי תאים. בשל כך השימוש בהם כתאים המיועדים להשתלה מוגבל למחלות מסוימות בלבד, ואפשרי רק אם ניתן לאסוף כמות תאים מספקת מגופו של התורם. השתלת מוח עצם או השתלת דם עשיר בתאי גזע הם הליך רפואי מקובל כטיפול במחלות רבות הקשורות למערכת הדם. אך טיפולים דומים, העשויים לסייע למיליוני חולים הלוקים במחלות אחרות הפוגעות פגיעה בלתי הפיכה ברקמה, אינם מתאפשרים בשלב זה, משום שעדיין אין אפשרות להשיג כמות מספקת של תאים ממוינים או של תאי גזע סומטיים שביכולתם להתמיין לתאים שיחליפו את התאים הפגועים. כך, למשל, על מנת לסייע לחולים הסובלים מפגיעה חמורה בחוט השדרה יש להשתיל תאים הקרויים אוליגודנדרוציטים והמייצרים את המִיֶילין, החומר המבודד העוטף את האקסונים ומאפשר להם להוליך אותות עצביים. לרוע המזל, אין דרך מעשית לקבל מאדם אחר תרומת אוליגודנדרוציטים או תאי אב שבכוחם להתמיין לתאים אלו.
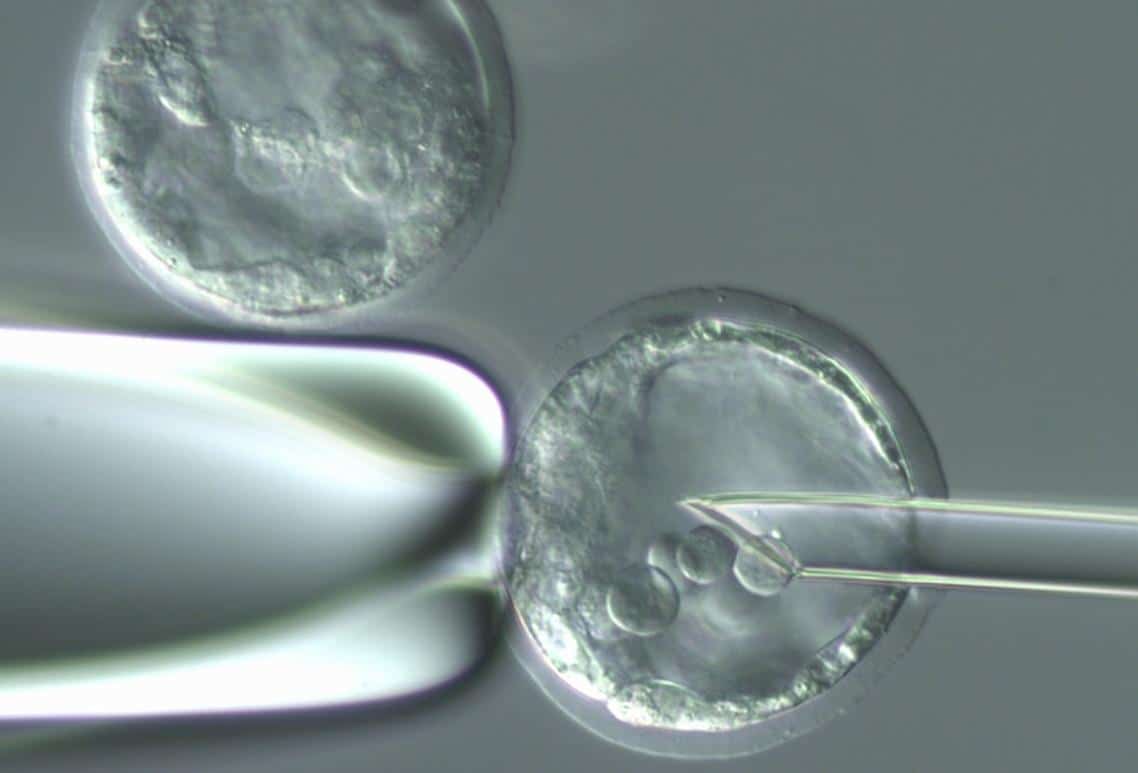
תאי גזע עובריים עשויים לשנות את התמונה. תאים אלו הם תאי גזע פלוריפוטנטיים, המופקים ממסת התאים הפנימיים שבבלסטוציסט חמישה ימים אחרי הפריה חוץ-גופית (איור 1). תאי הגזע העובריים יכולים, בתנאים מתאימים, להמשיך להתרבות כתאי גזע פלוריפוטנטיים ולשמש מקור למיליוני תאים, שבתנאי מעבדה אחרים יתמיינו לסוג התאים הרצוי. בדרך זו ניתן לקבל כמות מספקת של תאים ספציפיים המיועדים להשתלה. ואולם, בטרם יהפוך הליך רפואי זה לחזון נפרץ, יש צורך להגיע לבטיחות רפואית מקסימלית. בפרט, שלוש סכנות עיקריות מעכבות התחלה נרחבת של ניסויים קליניים: דחיית השתל, זיהומים בתאים המושתלים והתפתחות גידולים בגוף החולה. סכנות אלה התבררו במהלך חקר תאי הגזע ב-150 השנים האחרונות.
כושר ההתמיינות כחרב פיפיות
מהמאה ה-19 ועד ימינו, התקדם חקר תאי הגזע בשלושה ערוצים נפרדים – חקר תאי הגזע של מערכת הדם, חקר גידולים בגוף האדם ופיתוח ההפריה החוץ-גופית. הערוץ הראשון קשור להבנת המיקום והתפקוד של תאי גזע סומטיים בגוף האדם הבוגר. הראשון שהבין כי מוח העצם מכיל תאים שמהם נוצרים תאי הדם השונים היה החוקר הגרמני ארנסט נוימן (Neumann), שטען זאת כבר בשנת 1868. בתחילת המאה ה-20, החלו נוימן ואחרים להשתמש במונח "תאי גזע" גם לציון התאים ההמטופויאטיים ("יוצרי הדם") במוח העצם, וזאת נוסף על המשמעות שקיבל הצירוף כבר קודם לכן – תאים בעובר הראשוני. כבר בתחילת המאה שעברה עמדו אפוא חוקרים על הקרבה בין תאי הגזע הסומטיים לתאי הגזע העובריים.
היישום הרפואי הראשון של תובנותיו של נוימן היה השתלת מוח עצם בחולים הלוקים במחלות דם, אך בעיית הדחייה, קרי, נטייתו של הגוף לדחות שתל המכיל מידע גנטי שונה משלו, גרמה לכך שהשתלות אלה הפכו לשגרה רק במחצית השנייה של המאה ה-20, כאשר פותח טיפול תרופתי המונע דחייה. סכנת דחיית השתל צפויה להיות בעיה מרכזית גם בפיתוח השתלות אחרות של תאי גזע, והפתרון האולטימטיבי לבעיה זו עשוי להגיע מכיוונים בלתי צפויים.
במאה ה-19 החלו חוקרים מצרפת ומגרמניה להתעניין בגידול נדיר ומוזר הנקרא טרטומה (teratoma) – "גידול מפלצתי" ביוונית. טרטומה היא גידול שפיר, בדרך כלל, המכיל תערובת של תאים שמקורם בכל שכבות הנבט. לעתים מוצאים בתוך הגידול רקמות דמויות איברים, ואפילו חתיכות עור, שיניים שלמות או שערות. לפי הרכב התאים בטרטומה, ברור שמקורה בתא פלוריפוטנטי אחד או יותר, אך אופן היווצרותה אינו מובן די צורכו. עם זאת, סוג אחד של טרטומה כנראה פוענח: משערים שטרטומה בשחלה מקורה בביצית שעברה פרתנוגנזה (רביית בתולין), כלומר החלה להתחלק ללא הפריה. סוגי טרטומה אחרים מתפתחים כנראה כאשר האדם החולה עודנו עובר בבטן אמו, כתוצאה מליקוי בהתמיינות של תאי גזע עובריים. כאן מתבררת אחת הסכנות הכרוכות בהשתלת תאים שמקורם בתרבית של תאי גזע עובריים שעברו התמיינות מלאה או חלקית: אם יישארו בתרבית המושתלת תאי גזע פלוריפוטנטיים, הם עלולים להתפתח לגידול. לפיכך יש למצוא דרכים להיפטר מכל התאים הפלוריפוטנטיים לפני ההשתלה, או לגרום למוות מתוכנן שלהם באמצעות שינוי גנטי.
לא רק הטרטומה מקורה בתאי גזע, אלא גם סוגים אחרים של סרטן. משערים שרבות מצורות הסרטן נגרמות בשל סדרת מוטציות שהתחוללו בתאי גזע סומטיים ובתאי האב שנוצרו מהם, אשר החלו להתרבות באופן לא-מבוקר. מכאן שחקר תאי הגזע במעבדה, ובפרט שינויים גנטיים מכוונים של תאים אלה, יכולים ללמד אותנו לא מעט על מחלת הסרטן ולסייע בחיפוש מרפא לצורותיה השונות של המחלה.
עוברים כמקור לתאי גזע
הניסיונות הראשונים לבצע הפריה חוץ-גופית נערכו בסוף המאה ה-19, אך גם כאן נדרש זמן רב בטרם הבשילה הטכניקה והפכה לפרוצדורה מקובלת, כמאה שנים מאוחר יותר. "תינוקת המבחנה" הראשונה נולדה בבריטניה ב-1978. בדיעבד התברר כי שיטה זו, שנועדה לסייע לזוגות הסובלים מקשיי פוריות, סללה את הדרך להפקה סדירה של תאי גזע עובריים אנושיים.
הפריה חוץ-גופית כרוכה, בשלב ראשון, בטיפול הורמונלי באישה, שנועד לגרום לכמה ביציות להבשיל בבת-אחת. בשלב הבא שואבים משחלותיה כעשר ביציות בממוצע. ביציות אלו מופרות בתאי זרע, ומקצת העוברים הנוצרים מועברים לרחם כעבור ימים אחדים. שאר העוברים מוקפאים בחנקן נוזלי לצורך ניסיונות נוספים. מרבית העוברים הללו, שמספרם כיום מוערך במאות אלפים ברחבי העולם, מושמדים כעבור שנים מספר אם בני הזוג אינם מעוניינים לשוב ולהרות או לתרום אותם לזוג אחר.
במדינות מסוימות, בני הזוג יכולים לתרום את העוברים העודפים למחקר. בישראל ובמדינות רבות אחרות אין משלמים לבני זוג העושים זאת, וכן חל איסור ליצור עוברים עודפים בכוונה תחילה. עוברים שנמצא בהם פגם במהלך בדיקה מיקרוסקופית, או שהתגלה בהם פגם גנטי, מושמדים בדרך כלל. פגמים גנטיים מתגלים בבדיקה הנקראת בדיקת טרום-השרשה; זוהי בדיקה שאינה פוגעת בעובר המתפתח, ואשר כוללת הוצאת תא אחד, בלסטומר (blastomere), ממורולה בת שמונה תאים, והעברתו לבדיקה גנטית. בקרב החוקרים דווקא יש עניין לקבל תרומה של עוברים פגומים, שאם לא כן היו צפויים להיות מושמדים ממילא. תאי גזע מעוברים כאלו הם כלי חשוב בהבנת ההשפעה של פגמים גנטיים על העובר המתפתח.
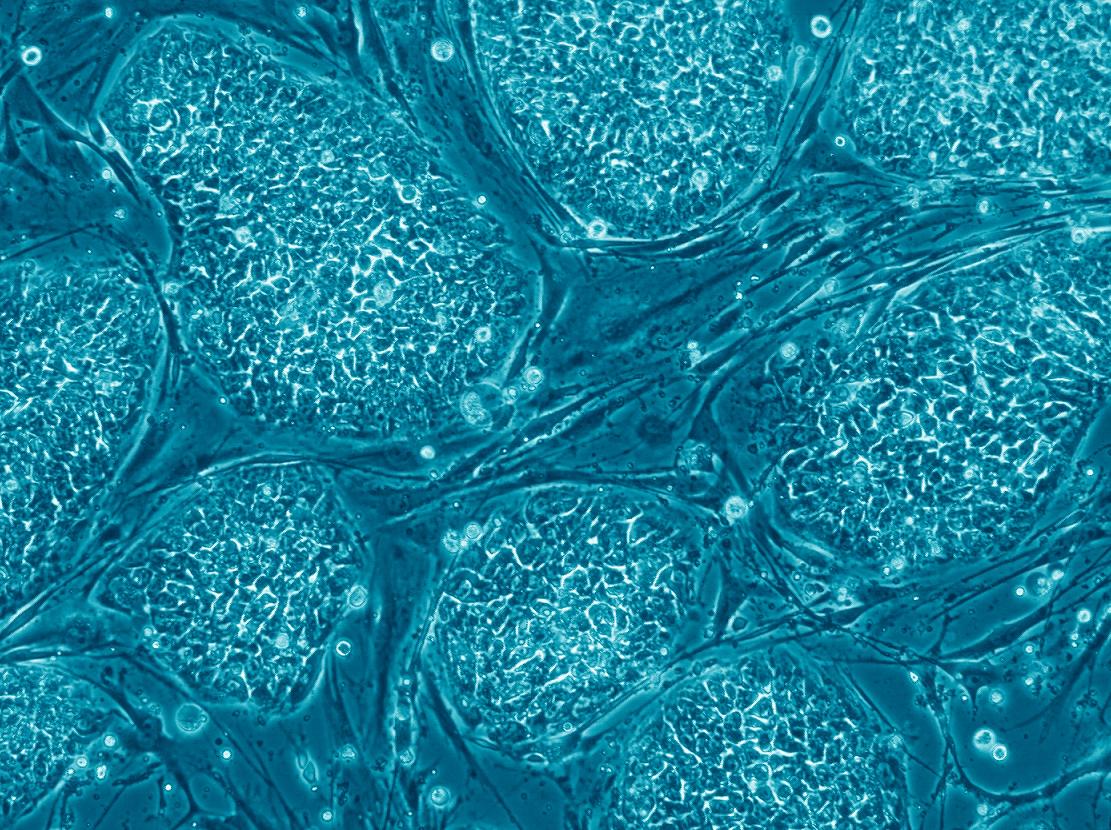
יצירת עוברים בהפריה חוץ-גופית הובילה בסופו של דבר לפריצת דרך בחקר תאי הגזע. החוקר הבריטי מרטין אוונס (Evans) הכיר את תחום תאי הגזע עוד ממחקריו הקודמים בטרטומות, אך הוא הבין שכדי לפתח שיטות מעבדה מדויקות יותר עליו להפיק את תאי הגזע ממקור אחר. ב-1981 הצליח אוונס, יחד עם עמיתו מתיו קאופמן (Kaufman), להפיק תאי גזע עובריים מבלסטוציסט של עכבר וליצור מהם תרבית תאים (איור 2). תרבית תאי גזע יציבה ממקור אחד נקראת שורת תאי גזע (stem cell line), והתאים שבה יכולים להמשיך להתקיים בצורה לא-ממוינת כל עוד יישמרו התנאים המתאימים. בהמשך השתמש אוונס בשורת תאי הגזע שהפיק ליצירת עכברים מהונדסים גנטית. על עבודתו זו זכה בשנת 2007 בפרס נובל לרפואה.
פריצת הדרך הבאה התרחשה ב-1998. קבוצת המחקר של ג'יימס תומסון (Thomson) מאוניברסיטת ויסקונסין בארצות הברית, ששיתפה פעולה עם פרופ' יוסף איצקוביץ-אלדור מהטכניון ומבית החולים רמב"ם בחיפה, הייתה הראשונה שהפיקה תאי גזע עובריים אנושיים ויצרה מהם שורת תאי גזע. תאי הגזע העובריים הקטנטנים מופקים ממסת התאים הפנימיים בבלסטוציסט, ולשם כך יש לנקב את שכבת הטרופובלסט ולהוציא את התאים הפנימיים. בתהליך זה העובר נהרס ואינו ממשיך להתפתח. תאי הגזע העובריים האנושיים מגודלים על מצע של תאי עכבר, בדרך כלל תאי פיברובלסט, שעברו טיפול כך שלא יתחלקו (איור 3). זהו מצע דביק המחזיק את התרבית ומספק לה חומרי מזון ופקטורים שונים, שמפרישים הפיברובלסטים והחיוניים לשמירה על תכונותיהם של תאי הגזע העובריים.
מצע תאי העכבר בעייתי משתי סיבות: אנטיגנים עלולים לחדור מתאי העכבר לתאים האנושיים ולגרום לדחייתם בעת ההשתלה; ופתוגנים עלולים לעבור מתאי העכבר לתאים האנושיים ולגרום למחלות. משום כך חברות שונות מנסות לפתח מצע סינתטי חלופי בטרם יחלו הניסויים הקליניים, ואכן, המצע הסינתטי החדש שפותח עבור חברת הביוטכנולוגיה המובילה Geron עתיד לשמש לגידול תאים המיועדים להשתלה.
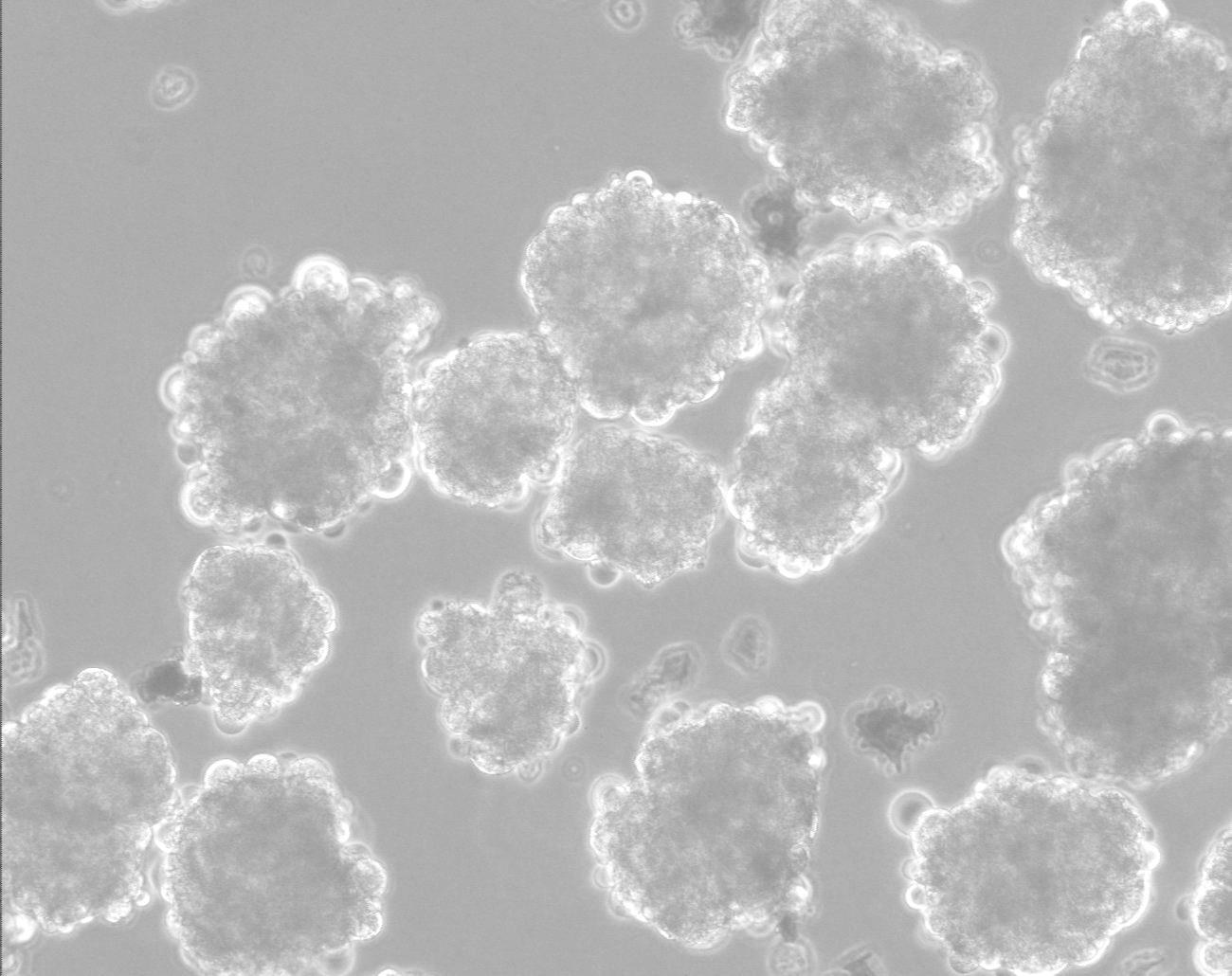
לאחרונה הצליחה קבוצת המחקר של פרופ' בנימין ראובינוף, מבית החולים הדסה, לגדל תרבית של תאי גזע עובריים מאדם בתרחיף מבלי שהתאים יתמיינו. צוות החוקרים מצא שבעת גידול תאי הגזע בנוזל המשמש להתמיינות מכוונת לתאי עצב, חלק נכבד מתאי הגזע לא התמיינו. בעזרת אופטימיזציה של הפרוטוקול, נמצאה דרך מעשית לגדל בתרחיף כמות גדולה של תאי גזע אנושיים, שנותרו פלוריפוטנטיים. לשיטה החדשה יש השלכה על היכולת לייצר כמויות גדולות של תאי גזע במאמץ קטן יחסית (איור 4).
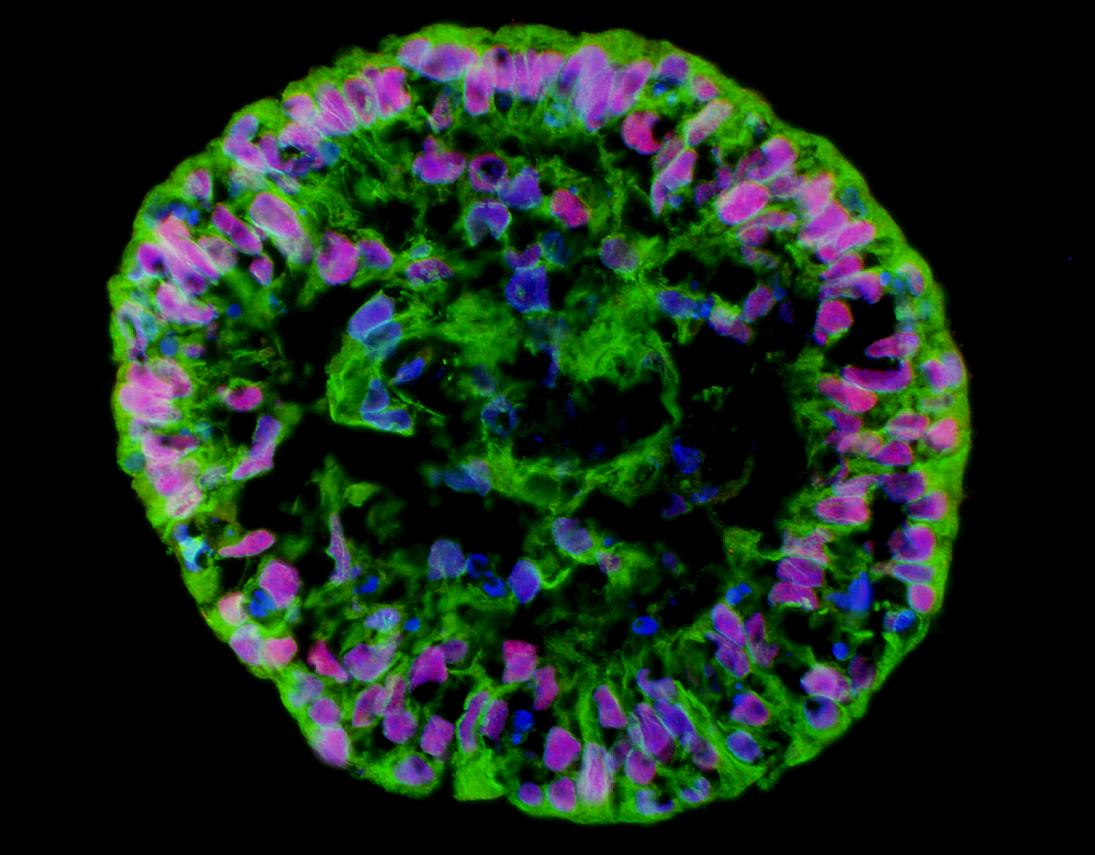
לאחר שתרבית תאי גזע פלוריפוטנטיים גדלה באופן תקין ומבלי להתמיין במשך חצי שנה, ניתן להכריז עליה כעל שורת תאים. כיום כבר יש כמה מאות שורות תאים כאלו ברחבי העולם. מדי כמה חודשים יש לשוב ולבדוק את תרבית תאי הגזע, על מנת לוודא שהיא שומרת על פלוריפוטנטיות. הבחינה כוללת בדרך כלל מעקב אחר קצב החלוקה; בדיקה מיקרוסקופית שנועדה לוודא שלא הופיעו תאים ממוינים; זיהוי גורמי תעתוק המאפיינים תאי גזע לא-ממוינים, דוגמת Nanog ו-Oct4; זיהוי סמנים הנמצאים על פני שטח התאים, המאפיינים תאי גזע לא-ממוינים; בדיקת קריוטיפ בעזרת מיקרוסקופ; ובדיקת גידול תקין לאחר הקפאה, הפשרה והעברה לצלחת פטרי חדשה. יש גם לוודא, שיכולת ההתמיינות של התאים לא נפגעה. לשם כך מעבירים כמות קטנה של תאים למצע נוזלי לשם יצירת תרחיף, ובודקים אם מתחיל להיווצר גופיף דמוי-עובר (embryoid body) המכיל תאי גזע ממוינים משלוש שכבות הנבט (ראו איור בפתח המאמר). דרך נוספת לוודא שהתרחשה התמיינות היא להזריק תאים לעכבר בעל מערכת חיסון מדוכאת (על מנת למנוע דחייה). הזרקה כזו אמורה ליצור בגופו טרטומה שפירה.
כל שורת תאים מספקת לחוקרים מקור אינסופי של תאי גזע שתכונותיהם ידועות, ושניתן לקבל מהם במקרה הצורך תאים ממוינים שונים באמצעות ביצוע מניפולציות גנטיות או הוספה של פקטורים ספציפיים. התאים הממוינים יכולים לשמש כתרבית לבחינת השפעתן של תרופות חדשות לפני הוצאתן לשוק או כמקור תאים להשתלה בחולים. ואולם, סכנת הדחייה נותרת בעינה, ועל מנת להתגבר עליה דרושות שיטות אחרות.
מכשולים אתיים
על מנת להימנע מדחיית שתל ללא דיכוי מערכת החיסון של המטופל, הליך רפואי העלול להיות מסוכן, נדרש שהמידע הגנטי בתאים המושתלים יהיה זהה למידע הגנטי שבתאי הגוף של המטופל. המענה לאתגר זה הוא שיבוט רפואי. השיבוט מבוסס על העברת גרעין מתא סומטי רגיל, בדרך כלל תא עור, לביצית לא-מופרית שגרעינה הוצא ממנה. פולס חשמלי גורם לאקטיבציה, שבעקבותיה מתחילה הביצית להתחלק. כאשר העובר מגיע לשלב הבלסטוציסט, ניתן להפיק ממנו ממנו תאי גזע עובריים המכילים את המידע הגנטי של המטופל. בדרך זו ניתן ליצור שורת תאי גזע אישית לכל חולה הזקוק להשתלה, ולהתגבר על סכנת הדחייה.
שיטה זו מעוררת התנגדות משני סוגים: יש הטוענים ששיבוט תאי אדם, גם אם אינו מביא להולדת תינוק, אינו מוסרי, ויביא ללגיטימציה של שיבוט בני אדם לצורכי רבייה; גם הפקת תאי גזע מעובר תוך כדי השמדתו היא בעיה ביו-אתית בעיני רבים, אף אם מדובר בעוברים שיושמדו ממילא. סוגיה זו קשורה לשאלת הרגע שבו העובר הופך לאדם. שאלה זו אינה מדעית גרידא, ובדיון בה יש להביא בחשבון גם שיקולים תרבותיים ודתיים. בעיני הנצרות הקתולית, רגע ההתעברות הוא רגע תחילת החיים, ומכאן התנגדותו החריפה של הוותיקן להפקת תאי גזע עובריים. היהדות והאסלאם, לעומת זאת, טוענים שאין דינו של עובר בשלבי ההיריון הראשונים כדינו של עובר העומד לצאת לאוויר העולם. לפי הדעה הרווחת ביהדות, ניתן להשתמש למחקר בתאי עובר שבוודאות לא יועבר לרחם.
ואולם, ניתן להתמודד עם שתי הסוגיות האתיות בדרך אחרת – באמצעות פיתוחים טכנולוגיים-מדעיים שיבטלו את הצורך לפגוע בעוברים, ואת הנחיצות בשיבוט כדי ליצור שורת תאי גזע אישית. שני פתרונות כאלו אכן נמצאו לאחרונה.
תאים חוזרים בזמן
הפתרון הראשון, הפשוט יותר, מאפשר יצירה של שורת תאי גזע עובריים מבלי להרוס את העובר. בדיקה גנטית טרום-השרשה של עובר הנוצר בהפריה חוץ-גופית כרוכה כזכור בהוצאת תא יחיד – בלסטומר – מהמורולה. אם התא נמצא תקין, ניתן להעביר את העובר לרחם: הוצאת התא היחיד אינה פוגעת בעובר, והוא יכול להתפתח לתינוק בריא. כעת הצליחו חוקרים להשתמש בתא יחיד זה, במקום לאבחון גנטי – ליצירת תרבית של תאי גזע.
הפתרון השני, המורכב יותר, מתמודד גם עם בעיית הדחייה. הרעיון שבבסיסו הוא להפוך את כיוון ההתמיינות, כלומר לקחת תא סומטי מגוף אדם בוגר ולגרום לו לחזור למצב הפלוריפוטנטי שאפיין את אחד מאבותיו המוקדמים. הדבר נעשה באמצעות שינוי גנטי בתא הסומטי, הגורם לו לבטא גנים מסוימים. גנים אלו מקודדים לגורמי תעתוק, דוגמת Oct4 שהוזכר קודם לכן, המאפיינים את תא הגזע הלא-ממוין. התאים הנוצרים, הנקראים תאי גזע פלוריפוטנטיים מושרים (induced pluripotent stem cells – iPS cells), ניחנים במאפיינים של תאי גזע עובריים רגילים: הם יכולים להתחלק ולהישאר תאי גזע או להתמיין לתאים משלוש שכבות הנבט. ההצלחה הראשונה בתחום זה נרשמה במעבדתו של החוקר היפני שיניה יאמאנקה (Yamanaka), שהצליח ב-2006 להחזיר תאי עכבר בוגרים למצבם העוברי. שנה מאוחר הצליחו קבוצתו של יאמאנקה וקבוצתו של החוקר האמריקאי תומסון להגיע להישג דומה בתאי אדם.
ומה הלאה?
בשנים הקרובות צפויים להתחיל ניסויים קליניים בבני אדם, שיערכו חברות ביוטכנולוגיה מובילות דוגמת Geron. בניסוי המתוכנן הראשון יושתלו תאי אב של אוליגודנדרוציטים, שיופקו מתאי גזע עובריים אנושיים, בגופם של חולים הסובלים מפגיעה קשה בחוט השדרה. טיפול זה עשוי לסייע למטופלים להניע את גפיהם. תאי עצב ותאים אחרים הקשורים אליהם, שיופקו מתאי גזע, עתידים לשמש במגוון טיפולים חדשניים למחלות הפוגעות במוח ובמערכת העצבים, דוגמת מחלת אלצהיימר, מחלת פרקינסון ומחלת לו גריג (ALS). אם הרפואה הרגנרטיבית, הנשענת על השתלת תאים שהתמיינו מתאי גזע פלוריפוטנטיים, תנחל הצלחה בטיפול במחלות אלו ובמחלות קשות נוספות, כמו מחלות לב, מיליוני חולים ברחבי העולם יזכו לתקווה חדשה.
נושא מרתק, שחוקרי תאי הגזע עדיין רחוקים מלהבינו, הוא אוסף המנגנונים האפיגנטיים – כלומר, המנגנונים התורשתיים שאינם נובעים מרצף ה-DNA – אשר גורמים להתמיינות תאי הגזע ולהתפתחות האיברים בעובר הגדל. ידוע שההתמיינות מתאפיינת בהגבלת התבטאותם של גנים מסוימים, ושהגורמים המפעילים אותה הם כימיקלים שמפרישים תאים אחרים, מגע פיזי עם תאים שכנים ומולקולות בנוזל הנמצא סביב התאים (מיקרו-סביבה). ואולם, התמונה המפורטת טרם נחשפה. אולי כשיתבררו הפרטים הללו, נוכל להגשים את ההבטחה הגדולה ביותר של תאי הגזע – יצירת איברים שלמים המיועדים להשתלה.
מסגרת 1: ומה בישראל?
האם אתם חוקרים גם תאי גזע פלוריפוטנטיים מושרים (iPS cells)?
יצירת תאי גזע פלוריפוטנטיים מושרים היא פריצת דרך חשובה. אנו הצטרפנו למחקר בתחום, ופרסמנו בו שלושה מאמרים בשנה וחצי האחרונות. במאמר האחרון השווינו בין מודל למחלה גנטית בתאי גזע עובריים ובין מודל דומה בתאי iPS. גילינו שמבחינות רבות המודלים דומים, אבל בנקודה קריטית מסוימת הם שונים. למרות הדמיון בין שני סוגי התאים, חשוב להמשיך לחקור את ההבדלים.
האם תאים אלו יחליפו את תאי הגזע העובריים או שיכולת השימוש הרפואית בהם תהיה מוגבלת?
החוקרים נמצאים על סף ניסויים קליניים בתאי גזע עובריים בארצות הברית. לעומת זאת, השימוש הרפואי בתאי גזע מושרים עדיין אינו בטוח, מפני שכרגע יש צורך במניפולציות גנטיות כדי ליצור אותם. לכן אני יכול לומר בוודאות שניסויים קליניים בתאי גזע עובריים יקדימו את הניסויים הקליניים בתאי גזע מושרים. מצד שני, התאים המושרים מביאים עמם חידוש עצום, והוא האפשרות לייצר את התאים המושרים מגוף החולה עצמו ולהחזיר לו תאים זהים לתאי גופו מבחינה גנטית. בדרך זו לא תתרחש דחייה של השתל.
היכן עומד המחקר מבחינת היכולת לשלוט בהתמיינות של תאי הגזע?
בעשר השנים האחרונות פותחו פרוטוקולים רבים להתמיינות תאי גזע עובריים לסוגי תאים שונים, כמו עור, עצב וכבד. הקושי העיקרי כרגע הוא לקבל תרבית המכילה אך ורק תאים ממוינים. יש שיטות המאפשרות לנו לקבל תרבית כמעט נקייה של תאים ממוינים, למשל – בעזרת סורק תאים. ואולם, כמות התאים המתקבלת בשיטות אלה קטנה יחסית.
בניסויים הקליניים המתוכננים בארצות הברית, שבהם ישתילו תאים בגופם של חולים שעמוד השדרה שלהם נפגע פגיעה חמורה, הכוונה אינה להשתמש בסורק תאים, אלא בתרביות שאינן נקיות לגמרי מבחינת הרכב התאים, חרף הסכנה הברורה של התפתחות גידולים מתאים לא-ממוינים. אחת ההצעות היא להשתיל את התאים בשלב שהם תאי אב, כך שהם יעברו את ההתמיינות האחרונה בגופו של החולה. בצורה זו תקטן הסכנה להתפתחות גידולים, ויושג יתרון נוסף – התאים המושתלים יחדשו את רקמת החולה לאורך זמן. הסכנה היא שהם עלולים לא להתמיין נכון, ועל מנת לברר נקודה זו יש צורך בהמשך המחקר הבסיסי.
כיצד ניתן להתמודד עם סכנת הגידולים?
השתלה של תאי גזע לא-ממוינים היא מסוכנת. אנו הראינו לראשונה שגידולים אלה הם שפירים, ובכל זאת זוהי בעיה חמורה. פיתחנו כמה אסטרטגיות כדי להתגבר עליה. ראשית, פיתחנו שיטה להפריד בין סוגי התאים, כך שנוכל להשתיל רק תאים שאינם גורמים לגידולים. שנית, הראינו כיצד ניתן לחסל את הגידול אם הוא נוצר, או לחלופין להשתמש במניפולציות גנטיות הכוללות החדרה של "גן התאבדות" שיגרום למוות מתוכנן של התאים העלולים ליצור גידול.
היכן ממוקמת ישראל בכל הקשור לתוצאות ולהישגים בחקר תאי הגזע?
מבחינת המספר האבסולוטי של המחקרים, ישראל נמצאת במקום שני-שלישי בעולם, לצד בריטניה, ובמחקר משווה נמצא כי חוקרים מהארץ היו מעורבים במחצית מ-20 המאמרים החשובים בתחום. זאת אף על פי שהתמיכה הממשלתית במחקר בתאי גזע מוגבלת מאוד.
שאלה לסיום: האם לדעתך ניתן יהיה להצליח, ביום מן הימים, לגדל מתאי גזע איברים שלמים המיועדים להשתלה?
זו שאלה חשובה מאוד. יצירת עובר כרוכה בשני תהליכים: התמיינות ויצירת רקמות. אנו מצליחים להביא להתמיינות במעבדה, אבל עדיין לא מצליחים ליצור רקמה שלמה. גם במעבדה שלי נעשית עבודה בכיוון זה, ויש לנו כמה רעיונות חדשים. יצירת איברים במעבדה היא אחת המטרות הגדולות לטווח ארוך של חקר תאי הגזע.
מסגרת 2: דבר המחוקק
עקב הסוגיות הביו-אתיות שעוררו הפקת תאי גזע מעוברים ושימוש בטכניקות של שיבוט, נדרשו לנושא בתי המחוקקים של מדינות רבות. כל מדינה בחרה בדרך משלה, בהתאם ל"אקלים המדעי" בחוגי השלטון ובציבור, למעורבות הציבור וארגונים חוץ-פרלמנטריים בשאלות אתיות ולשיקולים דתיים ותרבותיים. עיון בחקיקה במדינות השונות מגלה הסכמה רחבה למדי בשני עניינים: איסור על שיבוט בני אדם לצורך רבייה ואיסור על שימוש בעוברי אדם בני למעלה משבועיים לצורכי מחקר.
תאי הגזע העובריים והכנסייה
ניתן לחלק את ההגבלות החוקיות במדינות השונות לשלוש רמות. המדינות המחמירות ביותר אוסרות כל מחקר בתאי גזע. לקבוצה זו שייכות בעיקר מדינות המתאפיינות בהשפעה חזקה של הכנסייה הקתולית, דוגמת פולין ואירלנד. בקבוצה השנייה נכללות מדינות המתירות הפקת תאי גזע עובריים, אך אינן מרשות ליצור עוברים המיועדים מראש למטרה זו. ניתן אפוא להפיק תאי גזע רק מעוברים שנוצרו למטרת רבייה בהפריה חוץ-גופית, ושאין בהם עוד צורך למטרה זו. קבוצה זו כוללת את ישראל ואת קנדה. המדיניות הליברלית ביותר מתירה יצירת עוברים לצורכי מחקר, אך מגבילה את גידולם ואת השימוש בהם לתקופה הראשונית של התפתחותם. בריטניה וסין משתייכות לקבוצה השלישית.
בין בוש לאובמה
לא כל מדינה מתאימה לאחת משלוש קבוצות אלו. גרמניה מתירה מחקר בתאי גזע עובריים, אך אוסרת את הפקתם בתחומה. המצב בארצות הברית מורכב עוד יותר. אין חוק פדרלי האוסר חקר תאי גזע עובריים, וכל אחת ממדינות ארצות הברית רשאית לקבוע לעצמה מה מותר ומה אסור בתחומה. היקף ההגבלות במדינות השונות מגוון, החל באיסור מוחלט וכלה במדיניות מתירה וליברלית. במדינות מתירניות קיימת בדרך כלל השקעה פרטית מסיבית בחקר תאי גזע, והמדינה עצמה רשאית להשקיע בנדיבות במחקר – אך כספי המחקר הפדרליים כפופים להחלטת הנשיא. ג'ורג' בוש, כאשר כיהן כנשיא, התנגד לחקר תאי גזע עובריים, אך אִפשר מימון פדרלי קטן שיועד לשורות תאי גזע אשר נוצרו לפני אוגוסט 2001. אובמה נקט עמדה הפוכה, וביטל את ההגבלות של בוש על חקר מאות שורות תאי הגזע שנוצרו במהלך העשור האחרון. ואולם, המימון הפדרלי מותנה כעת באישור השורות בהתאם לקווים מנחים אתיים שגובשו בשנה שעברה, וכלל לא בטוח שכל השורות, בהן אפילו כאלו שנוצרו לפני הצהרתו של בוש, יזכו למימון הנדיב של ממשל אובמה.
מסגרת 3: שאלה של אפיגנטיקה
אפיגנטיקה היא תחום העוסק בחקר מנגנונים תורשתיים, המעורבים בקביעת הפנוטיפ ובהתבטאות גנים ואשר אינם נובעים מרצף ה-DNA. את תכונת הפלוריפוטנטיות של תאי הגזע העובריים קובע בראש ובראשונה מספר קטן של גורמי תעתוק. בין גורמי התעתוק הללו ניתן להזכיר את Oct4, את Nanogואת Sox2, המתבטאים בתאי גזע עובריים אנושיים. הניסויים שבהם הופקו לראשונה תאי iPS הראו, שהחדרת כמות קטנה של גנים המקודדים לגורמי תעתוק כגון אלו מסוגלת לגרום לתא סומטי ממוין לחזור למצב פלוריפוטנטי.
גורמי התעתוק בתאי הגזע משפיעים על התבטאות של גנים המקודדים לחלבונים, אשר קובעים את התכונות האפיגנטיות של התא. כך, למשל, חלבונים אלו עשויים לגרום למתילציה של DNA, כלומר להוספת קבוצה מתילית (CH3-) למקום ספציפי ב-DNA, הגורמת להפסקת ההתבטאות של מקצת גורמי התעתוק המאפיינים את המצב הפלוריפוטנטי. מתילציה זו, שתעבור בתורשה גם לצאצאיו של התא (de novo methylation), משפיעה על יציאה מהמצב הפלוריפוטנטי ועל תחילת ההתמיינות. לעומת זאת, דמתילציה של מקומות ספציפיים בהיסטונים – החלבונים המעורבים באריזת ה-DNA בכרומטין – עשויה לגרום לגורמי התעתוק המאפיינים את המצב הפלוריפוטנטי להמשיך להתבטא, ובכך לשמור על תאי הגזע במצבם הפלוריפוטנטי.
נוסף על מנגנוני המתילציה והדמתילציה, קיימים כנראה מנגנונים אפיגנטיים רבים נוספים, שחוקרים החלו לגלותם בשנים האחרונות. מנגנונים אלו כוללים שינויים שלאחר התרגום (post-translational modifications) בהיסטונים, שינויי מבנה בכרומטין ושינויים בארכיטקטורה של הגרעין. הבנה מלאה יותר של המנגנונים האפיגנטיים והקשרים המורכבים ביניהם תאפשר הבנה של תהליכי ההתחדשות וההתמיינות בתאי גזע שונים, ותאפשר לנו לשלוט בצורה יעילה יותר בתאי הגזע הגדלים בתרבית ובתאי הגזע בגוף האדם.
אודות הכותבים
ג'ודי מלמד-כץ היא כימאית המסיימת לימודי דוקטורט במיקרוביולוגיה באוניברסיטה העברית; עבדה בחברת טבע ובמז"פ, וכיום עוסקת בכתיבה ובחינוך מדעי.
אריה מלמד-כץ הוא מהנדס אלקטרוניקה ודוקטור לפיזיקה, בוגר מכון ויצמן למדע; עוסק כיום בכתיבה, מפתח תכניות חינוך מדעי, מרצה בנושאי מדע ומספק שירותי ייעוץ מדעי.
הבלוג של אריה
[email protected]
לקריאה נוספת:
* האתר של NIH על תאי גזע, ובו רשימת מקורות עדכנית והקווים המנחים החדשים לאישור שורות תאי גזע:
http://stemcells.nih.gov/
* אנימציה על תאי גזע:
* מאמר באנציקלופדיה לפילוסופיה של סטנפורד על האתיקה של חקר תאי גזע:
http://plato.stanford.edu/entries/stem-cells/
* דוח הוועדה המייעצת לענייני ביו-אתיקה של האקדמיה הלאומית הישראלית למדעים על השימוש בתאי גזע עובריים לצורכי מחקר רפואי:
http://bioethics.academy.ac.il/hebrew/report1/Report1-h.html
* אוסף מאמרים בנושא תאי גזע ב-Nature:
http://www.nature.com/stemcells/index.html
* מאמרים מרכזיים בהיסטוריה של חקר תאי הגזע:
א. יצירה ראשונה של שורת תאי גזע עובריים מעכבר:
Evans, M.J. and Kaufman, M.H., “Establishment in Culture of Pluripotential Cells from Mouse Embryos”, Nature 292(5819):154-156 (1981).
ב. יצירה ראשונה של שורת תאי גזע עובריים מאדם:
Thomson, J.A., Itskovitz-Eldor, J., Shapiro, S.S., Waknitz, M.A., Swiergiel, J.J., Marshall, V.S. and Jones, J.M., “Embryonic Stem Cell Lines Derived from Human Blastocysts”, Science 282(5391):1145-1147 (1998).
ג. יצירה ראשונה של תאי iPS מעכבר:
Takahashi, K. and Yamanaka, S., “Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors”, Cell 126(4):663-676 (2006).
ד. יצירת תאי iPS מאדם:
Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K. and Yamanaka, S., “Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors”, Cell 13(5):861-872 (2007).
Yu, J., Vodyanik, M.A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J.L., Tian, S., Nie, J., Jonsdottir, G.A., Ruotti, V., Stewart, R., Slukvin, I.I. and Thomson, J.A., "Induced Pluripotent Stem Cell Lines Derived from Human Somatic Cells", Science 318(5858):1917-1920 (2007).
ה. שיבוט רפואי ראשון של עובר אנושי:
French, A.J., Adams, C.A., Anderson, L.S., Kitchen, J.R., Hughes, M.R. and Wood, S.H., "Development of Human Cloned Blastocysts Following Somatic Cell Nuclear Transfer with Adult Fibroblasts”, Stem Cells 26(2):485-493 (2008).
ו. שימוש ראשון בבלסטומר יחיד כמקור לשורת תאי גזע עובריים אנושיים:
Klimanskaya, I., Chung, Y., Becker, S., Lu, S.J. and Lanza, R., “Human Embryonic Stem Cell Lines Derived from Single Blastomeres”, Nature 444(7118):481–485 (2006).

3 תגובות
המאמר ריתק אותי. הנושא החשוב הזה מוצג פה בצורה כל כך בהירה ומלהיבה. תודה רבה.
מאמר בסיסי מעולה, תודה.
בנוגע לניסויים הקליניים בתאי גזע עובריים – ייתכן מאוד שבנוסף לניסוי של חברת Geron בפגועי עמוד שידרה, יחל בארה"ב בקרוב גם ניסוי לטיפול במחלת ניוון הראיה Stargardt.
חברת Advanced Cell Technology צופה לקבל לקראת סוף אוגוסט את תשובת ה-FDA באשר לאישור הניסוי, ואם הוא יאושר – הוא יחל בפועל כשלושה חודשים לאחר מכן.
הצלחה של ניסוי זה תסלול את הדרך גם לניסויים בטיפול במחלת ניוון הראיה AMD.