חברת אוגמדיקס, שנוסדה לפני שנה וזכתה במקום הראשון בתחרות "ביזטק" בטכניון, גייסה 3 מיליון שקלים מחממת TerraLab ביקנעם * ReWalk משיקה דור שישי לשלד החיצוני
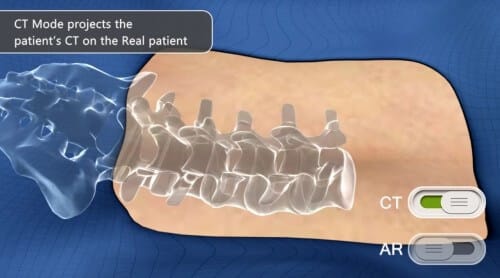
חממת TerraLab, הפועלת במסגרת תוכנית החממות של המדען הראשי, משקיעה 3 מיליון שקל באוגמדיקס (Augmedics LTD) – חברה שהוקמה במסגרת תחרות ביזטק בטכניון, וקטפה את המקום הראשון בביזטק 2014.
המערכת שאוגמדיקס מפתחת – ARGUS – מסייעת למנתחים לשפר את רמת הניתוח ואת בטיחותו. במהלך הניתוח מרכיב המנתח משקפי מציאות רבודה, המקרינים לו על גבי החולה עצמים מדומים תלת-ממדיים. לדוגמה, בניתוח אורתופדי מציגה המערכת למנתח, בזמן אמת, הדמיה של עצמות החולה במקומן האמיתי ומאפשרת לו לבצע את הניתוח באופן מדויק, כאילו ראה את העצמות מבעד לעור. המערכת מודגמת בסרטון הבא:
עם זכייתה של אוגמדיקס בתחרות בשנה שעברה אמר מנכ"ל החברה, ניסן אלימלך, כי "התחרות ציידה אותנו בכלים מעשיים לגיבוש התוכנית העסקית ובעזרה מעשית מהמנטורים, ובראש ובראשונה העניקה לנו מסגרת והכניסה אותנו לשגרת עבודה. כל זה סייע לנו בפיתוח הטכנולוגיה ובתכנון הכיוונים העתידיים בפיתוח המוצר שלנו, ARGUS ."
בשבוע שעבר נבחרו הפיינליסטים לגמר ביזטק 2015. מתוך 85 צוותים שהגישו מועמדות לתחרות נבחרו 12, ובהם Renty – פלטפורמה להשאלת ציוד בתשלום, המחברת בין משאילים למחפשים; Genees – רובוטים ורסטיליים מבוססי ארדואינו שאפשר לשלוט בהם מהסמארטפון; LabSuit – מערכת חדשנית לניהול מלאי ולמכירת חומרים עבור מעבדות בתחום הכימיה והביולוגיה. ו-Infuse – פתרון מבוסס תוכנה (בלבד) לניווט בתוך מבנים.
ReWalk משיקה את הדור השישי של השלד החיצוני – לשימוש בבית ובקהילה
חברת ReWalk Robotics הישראלית יצרנית מערכות שלד חיצוני ממונעות (exoskeleton), משיקה את הגרסה החדשה ביותר של המערכת האישית, ה- ReWalk Personal 6.0. הדור השישי של המערכת מציע לנפגעי חוט שדרה מוצר משודרג, המספק בין שאר היתרונות את מהירות ההליכה הגבוהה ביותר ואת ההתאמה המדויקת ביותר למשתמש. מדובר בגרסה החדשה ביותר של המערכת של ReWalk, אשר קיבלה את אישור ה-FDA , והיא מיועדת לשימוש בבית ובקהילה כאחד.
"השקת גרסת 6.0 מעניקה לנפגעי חוט השדרה שלד חיצוני, שתוכנן בצורה שתתאים טוב יותר למשתמש, תאפשר הליכה מהירה יותר ושליטה משופרת בפסיעה בהשוואה לדור הקודם," אמר מנכ"ל ReWalk לארי ג'סינסקי. "מאמצי התכנון שלנו מבוססים על שנות שימוש רבות של משתמשי המערכת ופילוסופיה הדוגלת בשיפור המוצר, כך שיתאים לכל ההיבטים של חיי היומיום. העיצוב מעניק התאמה אישית ברמה גבוהה ביותר באמצעות תוכנה המאפשרת התאמה למידות ולאנטומיה של כל משתמש באופן אינדיבידואלי. כל אלה משפרים את חווית השימוש בהשוואה לגרסאות הקודמות ובהשוואה למערכות שלד חיצוני אחרות, הנמצאות בניסויים קליניים ברחבי העולם."
יתרונות מערכת ReWalk 6.0 כוללים: התאמה מדויקת ביותר – למידותיו של המשתמש וייצור על פי המפרט האישי, מה שמאפשר שיפור התפקוד, הבטיחות והאיזון בין מפרקי המשתמש. מהירות הליכה גבוהה יותר- מחקרים קליניים שנערכו עם התקן ה-ReWalk המחישו שמשתמשי המערכת מסוגלים ללכת במהירות של 0.71 מטר לשנייה, מהר יותר מבכל מערכת אחרת של שלד חיצוני. תכנון יעיל יותר- הסרת מכלול הגב מפחיתה את המשקל המונח על הכתפיים ומעניקה למשתמש חופש בבחירת בגדים ותנועה. העיצוב החדש והנקי של הרצועות והמשטחים המרופדים מאפשר למשתמש ללבוש ולהסיר את המערכת יותר בקלות ובמהירות משופרת.
"הניסיון שרכשנו בשימוש יומיומי במערכות ReWalk והמשוב שאנו מקבלים מהקהילה, בשילוב עם התקדמות טכנית של צוות המחקר והפיתוח שלנו אפשרו לפתח ולייצר את הדור הבא של שלד חיצוני פרוסתטי," אמרה ג'ודי גריקי, מנהלת השיווק וההדרכה של ReWalk. "חוות הדעת של המשתמשים בגרסת 6.0 ממחישות שהם נהנים מהתאמה משופרת, שליטה טובה יותר בפסיעה ומנוחות רבה יותר, הודות להסרת מכלול הגב בדגם המשופר."
ReWalk היא היצרנית היחידה של שלדים חיצוניים בארה"ב המחזיקה באישור FDA הן עבור המערכת האישית (Personal) והן עבור המערכת השיקומית (Rehabilitation) של המוצר. החברה גם קיבלה אישור רגולטורי למערכות שהיא מייצרת באזורים נוספים בעולם, לרבות צפון אמריקה, אירופה, אסיה, המזרח התיכון ואוסטרליה. ה ReWalk הוא השלד החיצוני אשר נמצא בשימוש הנרחב ביותר ברחבי העולם, עם מערכות לשימוש אישי ומערכות לשימוש במרכזי שיקום במספר מדינות.
קבוצת HBL הדסית ביו מדווחת על אישורי פטנטים לחברת הבת סלקיור
חברת סלקיור נוירוסייאנסס הישראלית מקבוצת HBL הבורסאית המוחזקת על ידי הדסית ביו ב-21.2%, קיבלה אישור לרישום פטנט בארה"ב שכותרתו: METHODS OF CULTURING EMBRYONIC STEM CELLS AND CONTROLLED DIFFERENTIATION . הפטנט הינו בבעלות חברת ES Cell International אשר העניקה לסלקיור רישיון בלעדי לשימוש בפטנט. הפטנט מתייחס לשיטות להכוונת ההתמיינות של תאי גזע עובריים והבשלתם לתאי אב ובעל חשיבות בהגנה על הטכנולוגיה של סלקיור ליצור תאים בוגרים כגון תאי עצב לשם השתלה ורגנרציה.
מוצר OpRegen של סלקיור מיועד לטיפול במחלת ניוון הרשתית Dry AMD , המכיל תאי פיגמנט (RPE) של הרשתית המופקים מתאי גזע עובריים ממקור הומני בעזרת שיטת התמיינות תאים מוגנת פטנטים. סלקיור קיבלה את אישורי ה- FDA ומשרד הבריאות להתחלת ניסויים קליניים במוצר ה- OpRegen וכן אישור מוועדת הלסינקי במרכז למחקר קליני אשר במרכז הרפואי הדסה בירושלים לביצוע ניסוי קלינישלב 1 ו-2
קמהדע מודיעה על פרסום בכתב העת המדעי Pediatric Diabetes
קמהדע, חברת תרופות המייצרת מוצרים מבוססים על חלבוני פלסמה ומתמקדת בתרופות יתום, מדווחת על פרסום נתונים חיוביים בכתב העת המקצועי Pediatric Diabetes מהניסוי הקליני שלב 1/2 במוצר המוביל שלה, אלפא-1 אנטיטריפסין (AAT) ממקור הומני הניתן בעירוי, לטיפול בילדים חולי סוכרת מסוג 1 (T1D) שאובחנו לאחרונה.
במחקר שלב 1/2 גלוי תווית, שנערך במשך 37 שבועות, נבדקו ילדים עם סוכרת מסוג 1 (T1D) שאובחנה לאחרונה. במחקר השתתפו 24 חולים שקיבלו 18 טיפולים של 40, 60, או 80 מ"ג/ קילוגרם/מנה של AAT במשך תקופה של 28 שבועות. המדדים העיקרים בניסוי היו בטיחות וסבילות. המדדים השניוניים כללו איזון גליקמי, C-peptide, ורמות נוגדנים. מגיבים אפשריים לטיפול הוגדרו מטופלים עם רמות C-peptide שהראו ירידה של פחות מ- 7.5% מנקודת התחלה.
לא דווחו תופעות לוואי מהותיות, מקרים של קטאוצידוזיס (DKA), או מצבי היפוגליקמיה חמורים. תופעות הלוואי לא היו קשורות למינון והיו ארעיות. מדדים הקשורים באיזון גליקמי השתפרו במהלך המחקר בכל הקבוצות, ללא קשר למינון. המוגלובין מסוכרר (HbA1c) ירד מ- 8.43% ל- 7.09% (ממוצע, p <0.001). בסוף המחקר, ל- 18 נבדקים (75%) נמדדו ערכי שיא של C-peptide ≥0.2 .pmol/mL שמונה מטופלים (33.3%) נחשבו כמגיבים פוטנציאלים והתאפיינו בזמן קצר יותר של מחלת סוכרת נעורים בהיכנסם לניסוי(54.5 ± 34.3 vs. 95.9 ±45.7 days, p=0.036) וירידה גדולה יותר ברמות ה- HbA1c שלהם במהלך תקופת המחקר (−2.94± 1.55 vs.−0.95± 1.83%, p=0.016).
במאמר, רחמיאל ואחרים הגיעו למסקנה כי "טיפול ב- AAT היה בטוח וסביל באופן טוב בילדים עם סוכרת אוטואימונית שאובחנה לאחרונה. יש לציין שזהו המחקר הראשון שמדגים בטיחות גבוהה בשימוש במינונים שונים של AAT הניתן בעירוי לילדים שאינם חולים במחלת החסר הגנטי באלפא -1 (AATD) וחולים בסוכרת מסוג-1 שאובחנה לאחרונה, תוך שמירה על האיזון הגליקמי וירידה פחותה ברמות ה- C-peptide.
"אנו שמחים על הנתונים החיוביים הללו שפורסמו בכתב העת Pediatric Diabetes היות שהם מאמתים תוצאות ממחקרים קודמים שהראו שטיפול ב- AAT יכול להפחית סמנים פרו- דלקתיים ועשוי להגן על תאי הלבלב מפני תגובות אוטואימוניות בחולי סוכרת שאובחנו לאחרונה כפי שנמדדו על ידי רמות HbA1C ו- C-peptide", ציין עמיר לונדון, מנכ"ל קמהדע. "אנו ממשיכים בגיוס חולים לניסוי שלב 2/3 שלנו לטיפול באמצעות AAT בחולי סוכרת מסוג-1, שאובחנו לאחרונה ומצפים להתקדמות בניסוי חשוב זה, שעשוי, כפי שאנו מאמינים, לשנות את הדרך בה מטפלים בחולי סוכרת מסוג 1."

תגובה אחת
אהבתי , המערכת שמדמה עצמות זו מערכת מצוינת , יש מקום לשיפור ולניצול . מצויין